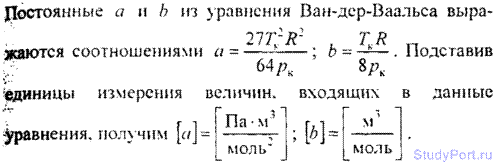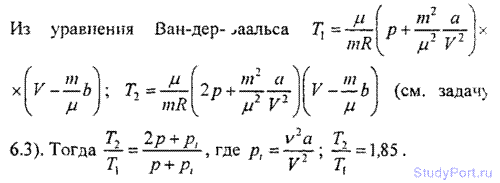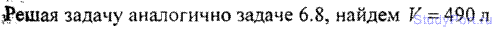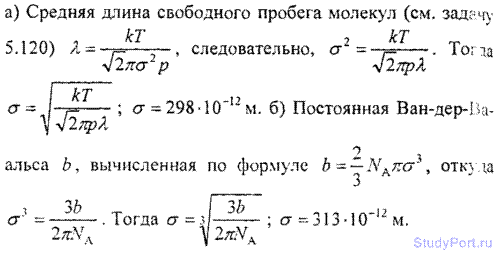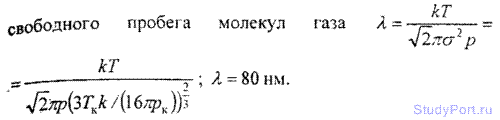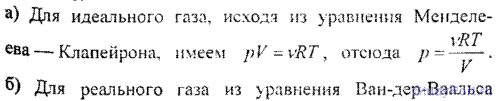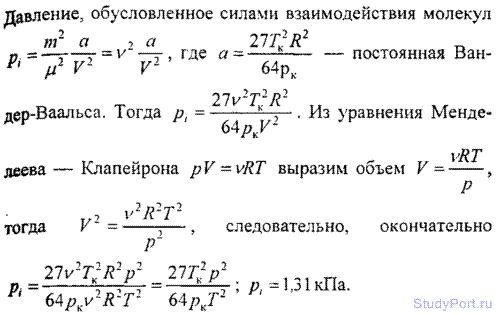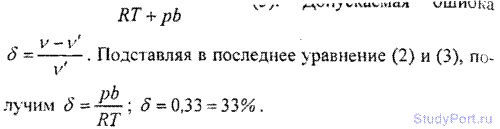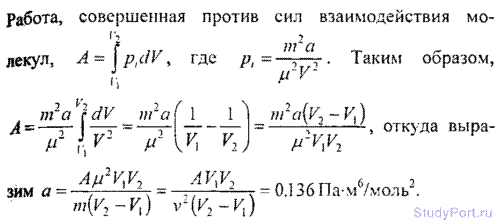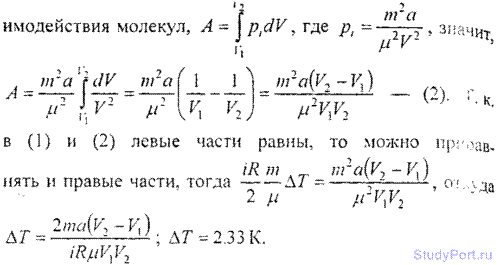Страница 1 из 2
6.1. В каких единицах системы СИ выражаются постоянные а и b, входящие в уравнение Ван-дер-Ваальса?
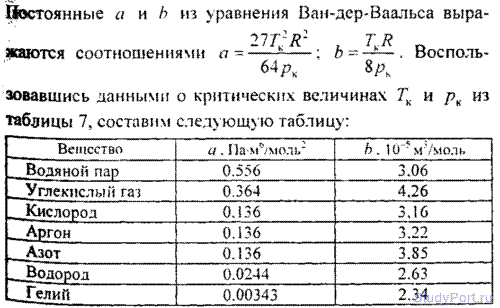
6.2. Пользуясь данными о критических величинах Тк и pк для некоторых газов (смотри таблицу), найти для них постоянные а и b , входящие в уравнение Ван-дер-Ваальса.
6.3. Какую температуру Т имеет масса m = 2 г азота, занимающего объем V = 820cm3 при давлении p = 0,2 МПа? Газ рассматривать как: а) идеальный; б) реальный.
6.4. Какую температуру Т имеет масса m = 3,5 г кислорода занимающего объем F=90cm3 при давлении p = 2,8МПа? Газ рассматривать как: а) идеальный; б) реальный.
6.5. Масса m = 10 г гелия занимает объем V = 100 см3 при давлении p = 100 МПа. Найти температуру Т газа, считая его: а) идеальным; б) реальным.
6.6. Количество v = 1 кмоль углекислого газа находится при температуре t = 100° С. Найти давление p газа, считая его:
а) реальным; б) идеальным. Задачу решить для объемов V1 = 1 м3
и V2= 0,05 м3.
6.7. В закрытом сосуде объемом V = 0,5 м3 находятся коли-
чество v = 0.6 кмоль углекислого газа при давлении p = 3 МПа.
Пользуясь уравнением Ван-дер-Ваальса, найти, во сколько раз надо увеличить температуру газа, чтобы давление увеличилось вдвое.
6.8. Количество v = 1 кмоль кислорода находится при температуре t=21°C и давлении p = 10МПа. Найти объем V газа,
считая, что кислород при данных условиях ведет себя как реальный газ.
6.9. Количество v = 1 кмоль азота находится при температуре t = 27°C и давлении p = 5МПа. Найти объем V газа, считая, что азот при данных условиях ведет себя как реальный газ.
6.10. Найти эффективный диаметр а молекулы кислорода, считая известными для кислорода критические значения Тк и pк.
6.11. Найти эффективный диаметр а молекулы азота двумя способами: а) по данному значению средней длины свободного пробега молекул при нормальных условиях ? = 95 нм; б) по известному значению постоянной b в уравнении Ван-дер-Ваальса.
6.12. Найти среднюю длину свободного пробега ? молекул углекислого газа при нормальных условиях. Эффективный диаметр б молекулы вычислить, считая известными для углекислого газа критические значения Tk и pk.
6.1З. Найти коэффициент диффузии D гелия при температуре t = 17° С и давлении p = 150 КПа. Эффективный диаметр атома б вычислить, считая известными для гелия критические значения Тk и pk.
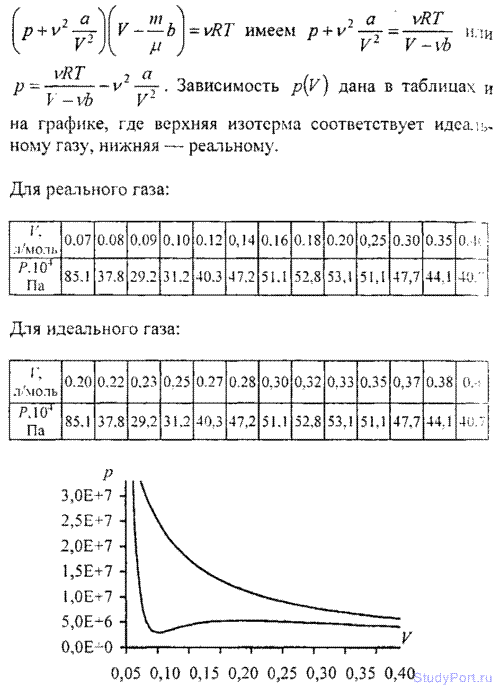
6.14. Построить изотермы p = f(v) для количества v = 1 кмоль углекислого газа при температуре t = 0° С. Газ рассматривать как: а) идеальный; б) реальный. Значения V (в л/моль) для реального газа взять следующие: 0,07, 0,08, 0,10, 0,12, 0,14, 0,16, 0,18, 0,20, 0,25, 0,30, 0,35 и 0,40; для идеального газа — в интервале 0,2 < V < 0,4 л/моль.
6.15. Найти давление p1, обусловленное силами взаимодействия молекул, заключенных в количестве v = 1 кмоль газа при нормальных условиях. Критическая температура и критическое давление этого газа равны Тk = 417 К и pk = 7,7 МПа.
6.16. Для водорода силы взаимодействия между молекулами незначительны; преимущественную роль играют собственные размеры молекул. Написать уравнение состояния такого полуидеального газа. Какую ошибку мы допустим при нахождении количества водорода v, находящегося в некотором объеме при температуре t = 0° С и давлении p = 280 МПа, не учитывая собственного объема молекул?
6.17. В сосуде объемом V = 10 л находится масса m = 0,25 кг азота при температуре t = 27° С. Какую часть давления газа составляет давление, обусловленное силами взаимодействия молекул? Какую часть объема сосуда составляет собственный объем молекул?
6.18. Количество v = 0.5 кмоль некоторого газа занимает объ-ем V1=1m3. При расширении газа до объема V2 = 1.2 м3 была
совершена работа против сил взаимодействия молекул A =5,684 кДж. Найти постоянную а, входящую в уравнение Ван-дер-Ваал ьса.
6.19. Масса m = 20 кг азота адиабатически расширяется в вакуум от объема V1 = 1 м3 до объема V2 = 1 м3. Найти понижение
температуры dT при этом расширении, считая известной для азота постоянную а, входящую в уравнение Ван-дер-Ваальса (смотри ответ 6.2).
6.20. Количества v = 0,5 кмоль трехатомного газа адиабатически расширяется в вакуум от объема V1 = 0,5 м3 до объема V2 = 3 м3. Температура газа при этом понижается на dT = 122 К. Найти постоянную а. входящую в уравнение Ван-дер-Ваальса.
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,662 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,978 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Лабораторная работа Определение средней длины свободного пробега и эффективного диаметра молекул воздуха
Цель
работы:
определить длину свободного пробега и
эффективный диаметр молекулы азота
(молекулы азота составляют 78,1
воздуха).
Методика эксперимента
При тепловом
движении молекул происходит их
столкновение. Процесс столкновения
молекул характеризуют величиной
эффективного диаметра молекул – это
минимальное расстояние, на которое
могут сблизиться центры молекул.
Расстояние, которое
проходит молекула между двумя
последовательными столкновениями,
называется средней
длиной свободного пробега
молекулы.
Молекулярно-кинетическая
теория позволяет получить формулы,
связывающие макропараметры газа
(давление, объём, температура) с его
микропараметрами (размеры молекул, их
масса, скорость).
Динамическая
вязкость
(коэффициент внутреннего трения) связана
со средней длиной свободного пробега
молекулы
уравнением:
, (2.13)
где
плотность газа;
средняя скорость молекул.
Из уравнения (2.13)
получим
. (2.14)
Вязкость
можно определить по формуле Пуазейля
(2.1):
, (2.15)
гдеr
– радиус трубки; l
– длина трубки; V
объем жидкости, протекшей через сечение
трубки за некоторое время t;
р
разность давлений на концах трубки.
Средняя скорость
молекул газа см.
формулу (1.26)
, (2.16)
гдеR
= 8,31
универсальная газовая постоянная; Т
– абсолютная температура;
молярная масса газа.
Плотность газа
определяем из уравнения Клапейрона-Менделеева
(1.7):
, (2.17)
гдер
– давление газа.
Подставляя формулы
(2.15), (2.16), (2.17) в выражение (2.14), получим:
. (2.18)
Введем коэффициент
А, объединив все постоянные величины
формулы (2.18): ,
тогда расчетная
формула для определения средней длины
свободного пробега молекул примет вид:
. (2.19)
Эффективный диаметр
d
молекулы связан с длиной свободного
пробега соотношением
, (2.20)
гдеn
– концентрация молекул газа при данных
условиях
, (2.21)
n0
= 2,31025м
-3 – число
Лошмидта (концентрация газа при нормальных
условиях Т0
= 273 К, р0
= 1,01105
Па).
Решая совместно
равенства (2.20) и (2.21), получим выражение
для эффективного диаметра молекул:
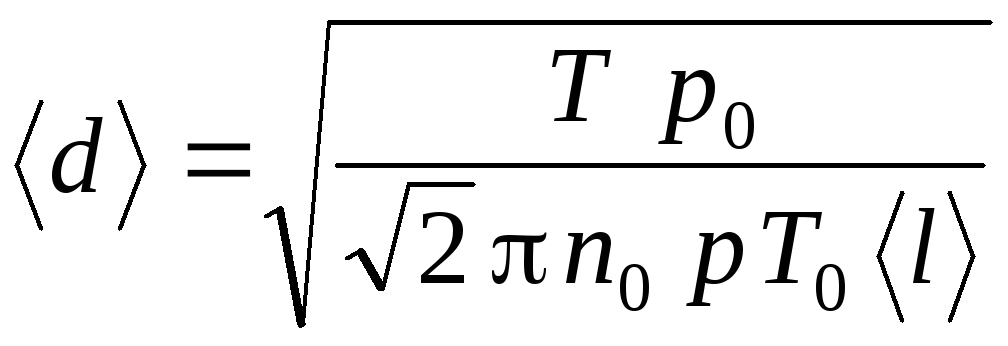
Введем коэффициент
b,
объединив все постоянные величины
формулы (2.22):
.
Р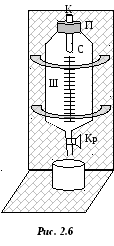
формула для определения эффективного
диаметра молекул примет вид:
. (2.23)
Лабораторная
работа выполняется на установке,
изображенной на рис. 2.6. стеклянный
сосуд С с краном Кр закрыт сверху пробкой
П, через которую пропущен капилляр К.
Для отсчета уровней воды на сосуде
имеется шкала Ш. Сосуд С заполняется
водой на
объема. При открытии крана Кр, вода
начинает выливаться из сосуда каплями,
а над поверхностью воды создается
пониженное давление. Концы капилляра
будут находиться под разным давлением:
верхний – под атмосферным; нижний –
меньше атмосферного. Это обусловливает
прохождение воздуха через капилляр.
Порядок выполнения
работы
-
Открыв пробку П,
заполнить сосуд С водой на
объема.
-
Подставить
мензурку. Открыв кран Кр, добиться
вытекания воды каплями. Включить
секундомер. -
Измерить по шкале
высоту h1
начального уровня воды в момент появления
первых капель. -
Набрав в мензурку
объем воды
V = 50см3,
закрыть кран Кр и остановить секундомер.
время
t
истечения жидкости записать в таблицу
2.4. -
Измерить уровень
h2
оставшейся в сосуде воды. -
Определить по
термометру температуру
воздуха Т
в лаборатории, а по барометру
атмосферное давление р. -
Записать в таблицу
значения радиуса r
и длины l
капилляра, указанные на установке. -
Пункты 1 – 5
повторить три раза, не
изменяя
значений h1
и V.
Таблица 2.4
|
h1 |
h2 |
V |
t |
Параметры |
постоянные |
р |
|
D |
|
50см3 |
r
l
T
р |
n0
R=8,31
=2910-3
1
Т0 Р0 |
||||||
Обработка результатов
измерений
-
вычислить
среднее значение времени истекания
жидкости
.
-
Вычислить среднее
значение высоты
.
-
Рассчитать разность
давлений р
на концах капилляра по формуле
.
-
Вычислить среднюю
длину свободного пробега молекулы
по формуле (2.19), подставляя данные
таблицы 2.4 в системе СИ (напомним).
-
Рассчитать
эффективный диаметр d
молекулы воздуха по формуле (2.23),
(напомним
).
-
Сравнить полученные
значения средней длины свободного
пробега
и эффективного диаметраd
молекулы с табличными (см. приложение). -
Сделать вывод по
проделанной работе.
Контрольные
вопросы и задания
-
Что понимают под
эффективным диаметром молекулы? -
Какую величину
называют средней длиной свободного
пробега? -
Записать уравнение,
связывающее коэффициент внутреннего
трения и длину свободного пробега.
Выразить из него длину свободного
пробега, и объяснить от каких величин
она зависит. -
Какой физический
смысл имеет число Лошмидта? -
Как рассчитывается
в данной работе разность давлений на
концах капилляра?
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Задание:
Найти среднюю длину λ свободного пробега молекул азота, находящегося в колбе диаметром D = 20 см при давлении Р = 100 мкПа и температуре Т = 280 К. Можно ли считать, что в колбе создан высокий вакуум? Эффективный диаметр молекулы азота dэф = 0,38 нм.