Связь между
молярной (Cm)
и удельной (с) теплоемкостями газа
Cm=cM,
где М
— молярная
масса газа.
Молярные
теплоемкости*
при
постоянном объеме и постоянном давлении
соответственно равны
Cv=iR/2;
Cp=(i+2)R/2
где i
— число
степеней свободы; R
— молярная
газовая постоянная.
Удельные
теплоемкости при постоянной объеме и
постоянном давлении соответственно
равны
,
.
Уравнение Майера
Cр—Сv=R.
Показатель
адиабаты
,
или
,
или.
Внутренняя
энергия идеального газа
U=N<>
или U=vCvT,
где <>—средняя
кинетическая энергия молекулы;
N—число
молекул газа;
v
— количество
вещества.
Работа, связанная
с изменением объема газа, в общем случае
вычисляется по формуле
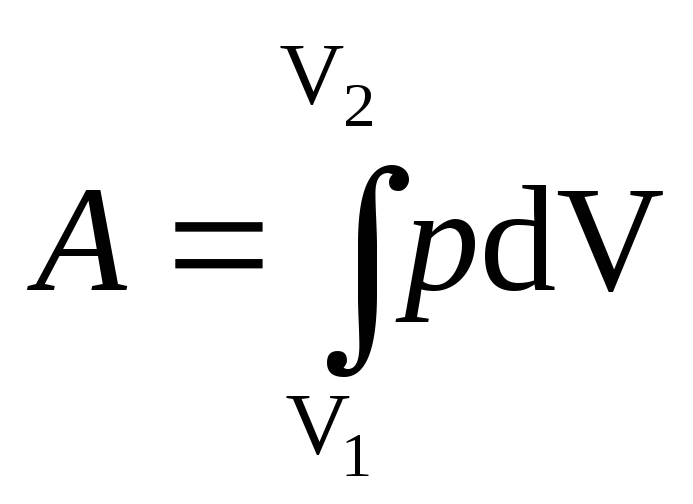
где V1
— начальный
объем газа; V2
— его
конечный объем.
Работа газа:
а) при изобарном
процессе (p=const)
A=p(V2
—
V1);
б) при изотермическом
процессе (T=const)
;
*
Здесь и далее
в целях упрощения записи в индексах
обозначений молярной теплоемкости при
постоянном давлении и постоянном объеме
букву «m»
будем опускать.
в) при адиабатном
процессе
,
или
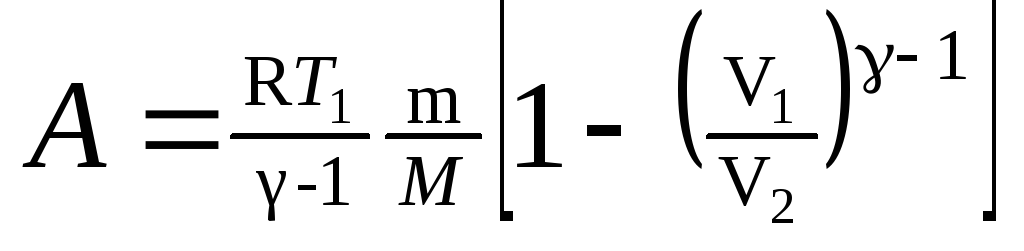
где T1
— начальная
температура газа; T2
— его
конечная температура.
Уравнение Пуассона
(уравнение газового состояния при
адиабатном процессе)
.
Связь между
начальным и конечным значениями
параметров состояний газа при адиабатном
процессе:
.
Первое начало
термодинамики в общем случае записывается
в виде
Q=U+A,
где Q
– количество теплоты, сообщённое газу;
U—изменение
его внутренней энергии; А
—
работа, совершаемая газом против внешних
сил.
Первое начало
термодинамики:
а) при изобарном
процессе
б) при изохорном
процессе (A=0)
;
в) при изотермическом
процессе (U=0)
,
г) при адиабатном
процессе (Q=0)
.
Термический
коэффициент полезного действия (КПД)
цикла
в
общем случае
,
где Q1—количество
теплоты, полученное рабочим телом
(газом) от нагревателя; Q2—количество
теплоты, переданное рабочим телом
охладителю.
КПД цикла Карно
,
или
,
где T1
— температура
нагревателя; T2
— температура
охладителя.
Изменение энтропии
где A
и B
— пределы
интегрирования, соответствующие
начальному и конечному состояниям
системы. Так как процесс равновесный,
то
интегрирование проводится по любому
пути.
Формула Больцмана
S=klnW,
где
S — энтропия
системы;
W
—
термодинамическая вероятность ее
состояния; k
—
постоянная Больцмана.
Примеры решения задач
Пример
1. Вычислить
удельные теплоемкости неона и водорода
при постоянных объеме (сv)
и давлении (cp),
принимая эти газы за идеальные.
Решение.
Удельные теплоемкости идеальных газов
выражаются формулами
; (1)
. (2)
Для неона (одноатомный
газ) i1=3,
M1=2010-з
кг/моль.
Подставив в формулы
(1) и
(2) значения
i1,
M1
и R
и произведя вычисления, найдем:
сv1=
624
Дж/(кгК);
сp1=1,04
кДж/(кгК).
Для водорода
(двухатомный газ) i2=5,
M2=210-3
кг/моль.
Вычисление по
формулам
(1) и
(2) дает
следующие значения удельных теплоемкостей
водорода:
сv2=10,4
кДж/(кгK);
сp2=14,6
кДж/(кгK).
Пример
2. Вычислить
удельные теплоемкости сv
и сp
смеси неона и водорода. Массовые доли
газов соответственно равны 1=0,8
и 2=0,2.
Значения удельных теплоемкостей газов
взять из примера
1.
Решение.
Удельную теплоемкость смеси при
постоянном объеме сv
найдем из следующих рассуждений. Теплоту,
необходимую для нагревания смеси на
T,
выразим двумя соотношениями:
Q=сv(m1+m2)T
(1)
где сv
— удельная
теплоемкость смеси; m1
— масса
неона; m2
— масса
водорода, и
Q=(сv1m1+
сv2m2)T (2)
где сv1
и сv2
— удельные
теплоемкости неона и водорода
соответственно.
Приравняв правые
части выражений
(1) и
(2) и разделив
обе части полученного равенства на
T,
найдем
сv(m1+m2)=
сv1m1+
сv2m2,
откуда
Отношения
1=m1/(m1+m2)
и 1=m2/(m1+m2)
выражают массовые доли соответственно
неона и водорода. С учетом этих обозначений
последняя формула, примет вид
сv=сv11+
сv22.
Подставив в эту
формулу числовые значения величин,
найдем
сv=2,58
кДж/(кгК).
Рассуждая
таким
же
образок, получим формулу для вычисления
удельной теплоёмкости смеси при
постоянном давлении:
cp=сp11+
сp22
Произведя вычисления
по этой формуле, найдем
cp=3,73
кДж/(кгК).
Пример
3. Определить
количество теплоты, поглощаемой
водородом массой m=0,2
кг при нагревании его от температуры
t1=0°С
до температуры t2=100
°С при постоянном давлении. Найти также
изменение внутренней энергии газа и
совершаемую им работу.
Решение.
Количество теплоты Q,
поглощаемое газом при изобарном
нагревании, определяется по формуле
Q=mcpT,
(1)
где m
— масса
нагреваемого газа; cp
— его
удельная теплоемкость при постоянном
давлении; T
— изменение температуры газа.
Как известно,
.
Подставив это выражение cp
в формулу
(1), получим
Произведя вычисления
по этой формуле, найдем
Q=291
кДж.
Внутренняя энергия
выражается формулой
,
следовательно, изменение внутренней
энергии
.
После подстановки
в эту формулу числовых значений величин
и вычислений получим U=208
кДж.
Работу расширения газа
определим по формуле, выражающей первое
начало термодинамики: Q=U+A,
откуда
A=Q — U.
Подставив значения
Q и U,
найдем
А
=83 кДж.
Пример
4. Кислород
занимает объем V1=1
м3
и находится под давлением р1=200
кПа. Газ нагрели сначала при постоянном
давлении до объема V2=3
м2,
a
затем при постоянном объеме до давления
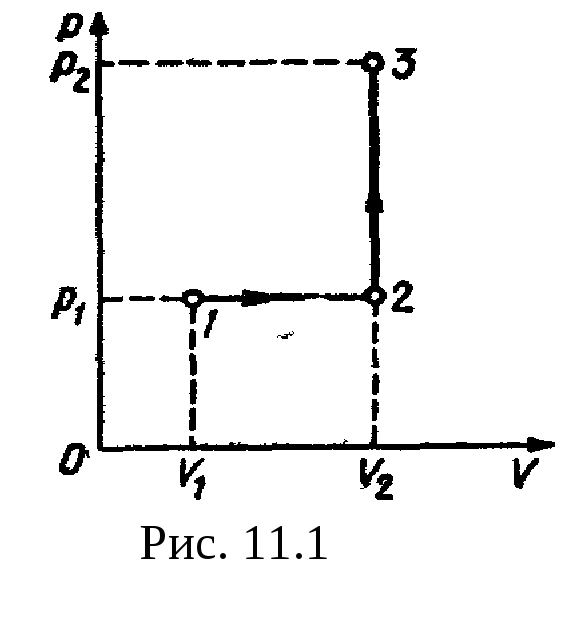
Рис
11.1 р2=500
кПа. Построить график процесса и найти:
1) изменение
U
внутренней энергии газа; 2)
совершенную им работу A;
3) количество
теплоты
Q,
переданное
газу.
Решение.
Построим график процесса (рис.
11.1). На
графике точками
1, 2, 3
обозначены состояния газа, характеризуемые
параметрами (р1,
V1,
T1),
(р1,
V2,
T2),
(р2,
V2,
T3).
1.
Изменение внутренней энергии газа при
переходе его из состояния
1 в состояние
3 выражается
формулой
U=cvmT,
где cv
— удельная
теплоемкость газа при постоянном объеме;
m
— масса
газа; T
— разность
температур, соответствующих конечному
3 и
начальному 1 состояниям, т. е. T=T3—
T1.
Так как
;
где М
— молярная
масса газа, то
.
(1)
Температуры T1
и T3
выразим из уравнения Менделеева
— Клапейрона
():
С учетом этого
равенство
(1) перепишем
в виде
U=(i/2)(p2V2—p1V1).
Подставим сюда
значения величин (учтем, что для кислорода,
как двухатомного газа, i=5)
и произведем вычисления:
U=3,25
МДж.
2.
Полная работа, совершаемая газом, равна
A=A1+A2,
где A1
— работа
на участке
1—2; A2
— работа
на участке
2—3,
На участке
1—2 давление
постоянно (p=const).
Работа в этом случае выражается формулой
A1=p1V=p1(V2—V1).
На участке 2—3
объем газа не изменяется и, следовательно,
работа газа на этом участке равна нулю
(A2=0).
Таким образом,
A=A1=p1(V2—V1).
Подставив в эту
формулу значения физических величин,
произведем вычисления:
A=0,4
МДж
3.
Согласно первому началу термодинамики,
количество теплоты Q,
переданное газу, равно сумме работы
A,
совершенной газом, и изменению U
внутренней энергии:
Q=A+U,
или
Q=3,65 МДж.
Пример
5. Идеальный
двухатомный газ, содержащий количество
вещества v=l
моль, находится под давлением p1=250кПа
и занимает объем V1==10
л. Сначала газ изохорно нагревают до
температуры T2=400
К. Далее, изотермически расширяя, доводят
его до первоначального давления.
После этого путем изобарного сжатия
возвращают газ в начальное состояние.
Определить термический КПД
цикла.
Решение.
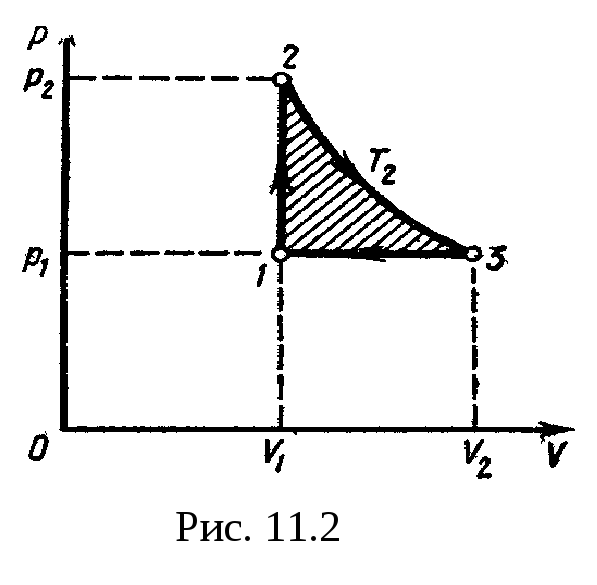
Для наглядности построим сначала график
цикла, который состоит из изохоры,
изотермы и изобары. В координатах р,
Vэтот
цикл имеет вид. представленный на рис.
11.2. Характерные
точки цикла обозначим
1, 2, 3.
Термический КПД
любого цикла определяется выражением
=(Q1
– Q2)/Q1,
или =l
– Q2/Q1,
(1) где
Q1
—
количество теплоты, полученное газом
за цикл от нагревателя; Q2
— количество теплоты, отданное газом
за цикл охладителю.
Заметим, что разность
количеств теплоты Q1
– Q2
равна работе A,
совершаемой газом за цикл.
Эта
работа на графике в координатах р,
V (рис.
11.2)
изображается площадью цикла (площадь
цикла заштрихована).
Рабочее вещество
(газ) получает количество теплоты
Q1
на двух участках: Q1-2
на участке
1—2 (изохорный
процесс) и Q2-3
на участке
2—3
(изотермический процесс). Таким образом,
Q1=Q1-2+Q2-3.
Количество теплоты,
полученное газом при изохорном процессе,
равно
Q1-2=Cvv(T2
–
T1),
где Cv
— молярная
теплоемкость газа при постоянном объеме;
v
— количестве вещества. Температуру T1
начального состояния газа найдем,
воспользовавшись уравнением Клапейрона
— Менделеева:
T1=p1V1/(vR).
Подставив числовые
значения и произведя вычисления, получим
Количество теплоты,
полученное газом при изотермическом
процессе, равно
Q2-3=vRT2ln(V2/V1),
где V2
—
объем, занимаемый газом при температуре
T2
и давлении p1
(точка
3 на графике).
На участке
3—1 газ
отдает количество теплоты Q2,
равное
Q2=Q3-1=Cpv(T2
–T1),
где Cp
— молярная
теплоемкость газа при изобарном процессе.
Подставим найденные
значения
Q1
и Q2
в формулу
(1):
В полученном
выражении заменим отношение объемов
V2/V1,
согласно закону Гей-Люссака, отношением
температур (V2/V1=T2/T1)
и выразим Cv
и Cp
через число степеней свободы молекулы
[Cv=iR/2,
Cp=(i+2)R/2].
Тогда после сокращения на
v
и R/2
получим
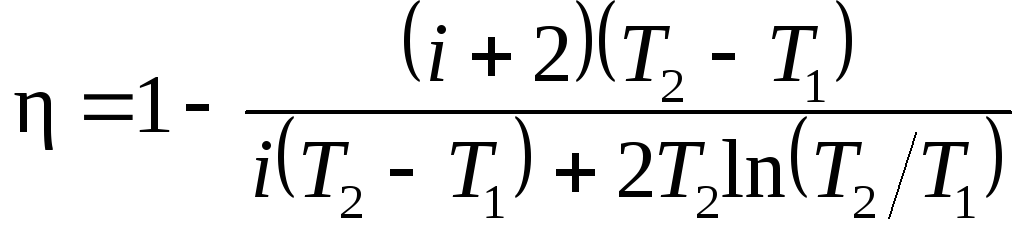
Подставив значения
i,
T1,
T2
и R
и произведя вычисления, найдем
Пример 6.
В цилиндре под поршнем находится водород
массой m=0,02
кг при температуре T1=300K.
Водород начал расширяться адиабатно,
увеличив свой объем в пять раз, а затем
был сжат изотермически, причем объем
газа уменьшился в пять раз. Найти
температуру Т2,
в конце адиабатного расширения и работу
А,
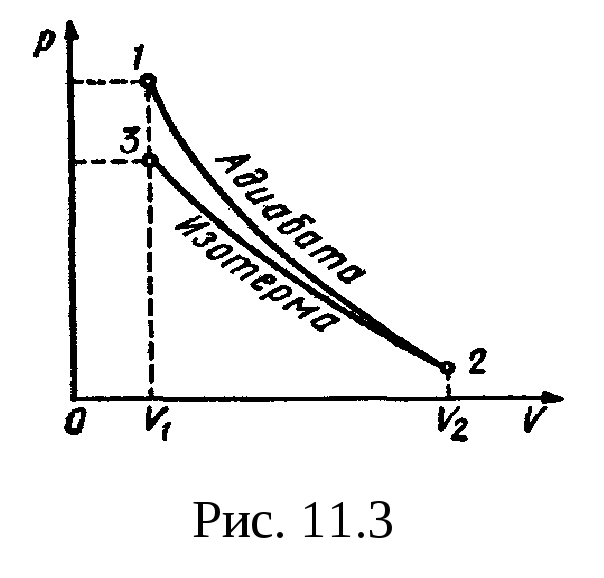
совершенную газом. Изобразить процесс
графически.
Решение.
Температуры и объемы газа, совершающего
адиабатный процесс, связаны между
собой соотношением
,
где —
показатель адиабаты (для водорода как
двухатомного газа =1,4).
Отсюда получаем
выражение для конечной температуры T2:
.
Подставляя числовые
значения заданных величин, находим
.
Прологарифмируем
обе части полученного выражения:
lgT2=lg300+0,4(lgl
— lg5)=2,477+0,4( -0,699)=2,477—0,280=2,197.
Зная lgT2,
по таблицам антилогарифмов находим
искомое значение T2:
T2=157
К.
Работа A1
газа при адиабатном расширении
определяется по формуле
.
Подставив сюда
числовые значения величин, после
вычисления получим
Работа A2
газа при изотермическом сжатии выражается
формулой
A2=RT2(m/M)ln(V2/V1).
Произведя вычисления
по этой формуле, найдем
A2=
-21 кДж.
Знак минус показывает,
что при сжатии газа работа совершена
внешними силами.
Общая работа,
совершенная газом при рассмотренных
процессах, А=A1+A2=29,8кДж
+ (-21 кДж)=8,8 кДж.
График процесса
приведен на рис.
11.3.
Пример
7. Нагреватель
тепловой машины, работающей по обратимому
циклу Карно, имеет температуру
t1==200°С.
Определить температуру Т2,
охладителя, если при получении от
нагревателя количества теплоты Q1=
1 Дж машина
совершает работу A=0,4
Дж? Потери на трение и теплоотдачу не
учитывать.
Решение.Температуру охладителя найдем, использовав
выражение для термического КПД машины,
работающей по циклу Карно,=(T1—
T2)/T1.
Отсюда
T2=
T1(1-).
(1)
Термический КПД
тепловой машины выражает отношение
количества теплоты, которое превращено
в механическою работу A,
к количеству теплоты Q1,
которое получено рабочим телом тепловой
машины из внешней среды (от нагревателя),
т. е. =A/Q1.
Подставив это выражение в формулу
(1), найдем
T2=
T1(1-A/Q).
(2)
Учтя, что T1=473
К, после вычисления по формуле
(2) получим
T2=284
К.
Пример
8. Найти
изменение S
энтропии при нагревании воды массой
m=100
г от температуры t1=0°C
до температуры
t2=100
°С и последующем превращении воды в пар
той же температуры.
Решение.
Найдем отдельно изменение энтропии S’
при нагревании воды и изменение энтропии
S»
при превращении ее в пар. Полное изменение
энтропии выразится суммой S’
и S».
Как известно,
изменение энтропии выражается общей
формулой
(1)
При бесконечно
малом изменении dT
температуры нагреваемого тела
затрачивается количество теплоты
dQ=mcdT,
где m
— масса
тела; с
— его
удельная теплоемкость. Подставив
выражение dQ
в равенство
(1), найдем
формулу для вычисления изменения
энтропии при нагревании воды:
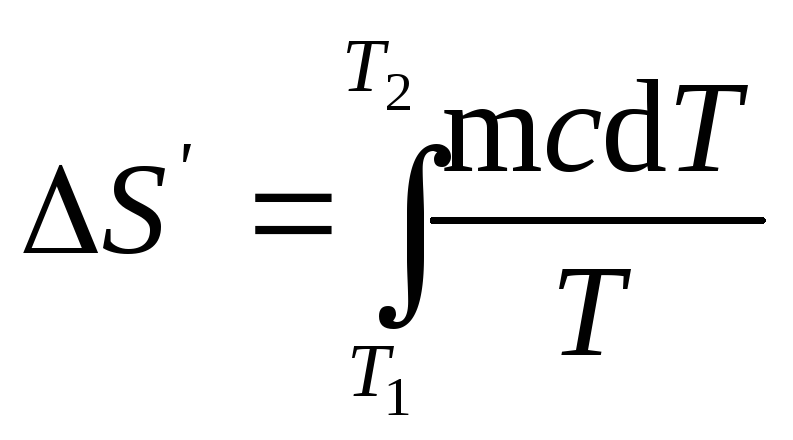
Вынесем за знак
интеграла постоянные величины и
произведем интегрирование, тогда получим
S’=mcln(T2/T1).
После вычислений
найдем S’=132
Дж/К.
При вычислении по
формуле
(1) изменения
энтропии во время превращения воды в
пар той же температуры постоянная
температуpa
T
‘выносится
за знак интеграла. Вычислив интеграл,
найдем
(2)
где Q
—
количество теплоты, переданное при
превращении нагретой воды в пар той
же температуры.
Подставив в равенство
(2) выражение
количества теплоты Q=m,
где
— удельная
теплота парообразования, получим
(3)
Произведя вычисления
по формуле
(3), найдем
S»=605
Дж/К.
Полное изменение
энтропии при нагревании воды и последующем
превращении ее в пар S=S’+S»=737
Дж/К.
Пример
9. Определить
изменение S
энтропии при изотермическом расширении
кислорода массой m=10
г от объема V1=25
л до объема V2=100
л.
Решение.
Так как процесс изотермический, то в
общем выражении энтропии
температуру выносят за знак интеграла.
Выполнив это, получим
(1)
Количество теплоты
Q, полученное
газом, найдем по первому началу
термодинамики: Q=U+A.
Для изотермического процесса U=0,
следовательно,
Q=A,
(2) а
работа А для этого процесса определяется
по формуле
A=(m/M)RT
ln(V2/V1).
(3)
С учетом
(2) и
(3) равенство
(1) примет
вид
S=(m/M)R
ln(V2/V1).
(4)
Подставив в
(4) числовые
значения и произведя вычисления, получим
S=(1010-3/(3210-3))
8,31
ln(10010-3/(2510-3))
Дж/К=3,60
Дж/К.
Тема: Определить значение y. (Прочитано 2089 раз)
0 Пользователей и 1 Гость просматривают эту тему.
При изобарическом нагревании от температуры t1 = 0°С до температуры t2 = 100 °С моль идеального газа поглощает Q = 3,32 кДж тепла. Определить значение y=Cp/Cv. (это пишется друг под другом)
Привет! Количество теплоты, поглощённое газом при Р=const Q=Cp·ν·ΔT, откуда молярная теплоёмкость газа при постоянном давлении
Cp=Q/(ν·ΔT)=3320/(1·100)=33,2 Дж/моль К
Для идеального газа справедливо выражение Cp=Cv+R , откуда молярная теплоёмкость газа при постояном объёме:
Cv=Cp-R=33.2-8.3=29.4 Дж/моль К, тогда получаем: y=Cp/Cv=33,2/29.4=1,13
Удачи!
СПАСИБО!!!
По словию задачи p/V = const, или p = const × V, а это линейная зависимость типа y = kx.
Графиком будет луч, выходящий из начала координат и проходящий через точки с температурами T1 и T2, давлениями p1 и p2, объемами V1 и V2.
По первому закону термодинамики:
Q = ΔU + A.
Q = (3/2)νRΔT + (1/2)νRΔT = 2νRΔT.
Работа численно равна площади трапеции:
A = (1/2)(p2 + p1)(V2 − V1).
После раскрытия скообок и сокращения имеем:
A = (1/2)νRΔT.
Q = 2 × 0,5 × 8,31 × 250 = 2077,5 (Дж).
2017-05-27
0,5 моль идеального одноатомного газа нагревают от температуры $T_{1} = 250 К$ до $T_{2} = 500 К$ так, что в процессе нагрева $p/V = const$. Определить молярную теплоемкость и рассчитать количество теплоты, поглощенное газом при нагревании.
Решение:
Рассмотрим график процесса в координатах $p, V$ и сравним его с изобарой, заключенной в тех же пределах температур (рис.). Поскольку состояния 2 и L лежат на одной изотерме ($T_{1} = T_{2}$), а газ идеальный, то изменения внутренней энергии в процессах 12 и 1L одинаковы:
$Delta U_{12} = Delta U_{1L} = Delta U_{p}$.
Работа, совершаемая газом в процессе 12, меньше, чем работа, совершаемая газом при изобарном нагреве. Графически работа $A_{12}$ численно равна площади, ограниченной графиком 12, осью абсцисс и ординатами $V = V_{1}$ и $V = V_{2}$. Работа $A_{1L}$ численно равна площади, ограниченной графиком 1L, осью абсцисс и ординатами $V = V_{1}$ и $V = V_{L}$.
Следовательно, количество теплоты, поглощенное газом в процессе 12, меньше, чем при изобарном процессе, поэтому и теплоемкость газа при этом процессе меньше, чем при изобарном, но больше, чем при изохорном процессе, так как газ совершает работу.
Молярная теплоемкость этого процесса может быть найдена непосредственно из первого начала термодинамики, записанного в дифференциальной форме:
$delta Q = dU + delta A = frac{i}{2} frac{m}{ mu} RdT + pdV$. (1)
С другой стороны, из определения молярной теплоемкости
$delta Q = frac{m}{ mu} CdT$, (2)
где $C$ — молярная теплоемкость заданного процесса.
Приравнивая правые части выражений (1) и (2), получаем
$C = frac{i}{2}R + frac{m}{ mu} p frac{dV}{dT}$. (3)
Второе слагаемое может быть найдено из уравнения заданного процесса и уравнения состояния газа.
Подставим выражение давления, полученное из уравнения Клапейрона — Менделеева $p = mRT/( mu V)$, поочередно в (3) и в уравнение процесса $p/V = const$:
$C = frac{i}{2}R + R frac{T}{V} frac{dV}{dT}$, (4)
$V^{2} /T = const$. (5)
Чтобы найти $dV/dT$, продифференцируем выражение (5) по переменной $T$:
$frac{2V (dV/dT)T — V^{2}}{T^{2}} = 0$,
откуда
$frac{dV}{dT} = frac{1}{2} frac{V}{T}$. (6)
Подставим выражение (6) в (4):
$C = frac{i}{2} R + frac{R}{2} = frac{i+1}{2} R$.
Искомая молярная теплоемкость постоянна, причем $C_{V} < C < C{p}$. Рассматриваемый газ — одноатомный ($i = 3$). Тогда $C = 16,6 Дж/(моль cdot К)$.
Количество теплоты, поглощенное газом при нагревании,
$Q_{12} = int_{T_{1}}^{T_{2}} delta Q = frac{m}{ mu} C (T_{2} — T_{1}) = 2,1 кДж$.