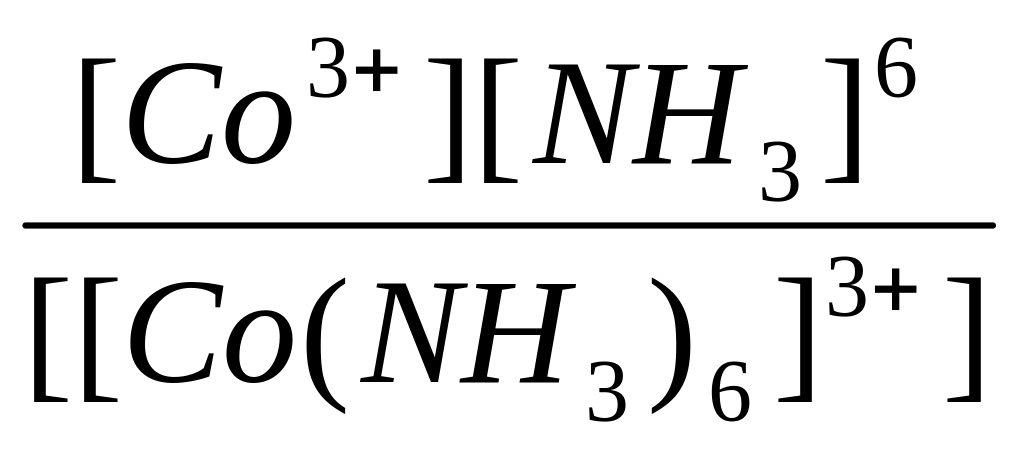Константа нестойкости комплексных ионов. Связь между комплексообразованием и произведением растворимости
Комплексный ион
способен диссоциировать на составные
части. В растворе, содержащем комплексные
ионы, устанавливается подвижное
равновесие, к которому применим закон
действующих масс:
[Co(NH3)6]3+
↔ Co3+
+ 6NH3
Константа равновесия
такого процесса называется константой
нестойкости.
KН
=
Чем меньше константа
нестойкости, тем более устойчив ион.
Константы нестойкости наиболее часто
встречающихся комплексных ионов даны
в таблице ___приложения.
Пример 1.
Дан 0,1М раствор комплексной соли
[Zn(NH3)4]SO4
, K
= 2,6 ×10-10
Определите: а)
концентрации ионов в растворе; б) степень
диссоциации комплексного иона.
Решение:
Диссоциация соли: [Zn(NH3)4]SO4
= [Zn(NH3)4]2+ +
SO4 2-
0,1 моль 0,1
моль 0,1 моль
Диссоциация
комплексного иона: [Zn(NH3)4]2+
= Zn
2+
+ 4 NH3
(0,1
–х) моль х моль 4х моль
КН
=
×10-10
. Так как х << 0,1 , то выражение в
знаменателе можно упростить: 0,1 – х ≈
0,1, тогда х = 2,52×10
-3 моль.
Степень диссоциации
α =
или 2,5%
Пример
2.
Можно ли растворить 0,5 моля йодида
серебра в растворе аммиака с конечной
концентрацией 1моль/л?
Произведение растворимости йодида
серебра ПРAgI
=1,5 ×10-16,
KН
[Ag(NH3)2]+
= 6,8×10-8.
Решение: Растворение
йодида серебра в аммиаке может быть
связано с образованием комплексного
иона [Ag(NH3)2]+.
Концентрация этого иона при полном
растворении должна быть 0,5 моль/л.
Пусть концентрация
ионов серебра [Ag
]+ в
аммиакате х моль/л. Концентрация аммиака
[NH3]
= 1 моль/л по условию. Тогда КН
=
;
х = 3,4× 10-8 .
Концентрацию ионов серебра [Ag]+
в насыщенном растворе иодида серебра
можно определить из величины произведения
растворимости: [Ag]+
= √ ПР = 1,22×10-8
. Это немного ниже концентрации,
вычисленной для иона серебра в растворе
комплексного иона, следовательно,
растворения иодида серебра в аммиаке
не произойдет, так как ионы серебра в
иодиде связаны сильнее, чем в комплексе.
Пример 3. а) Можно
ли разрушить комплекс [Ag(NH3)2]+,
концентрация которого в растворе 0,1
моль/л, добавлением раствора хлорида
калия равного объема и равной концентрации?
(увеличением объема при сливании
растворов пренебречь!)
б)
Возможно ли разрушение того же комплекса
при наличии избытка аммиака, концентрация
которого в растворе 10 моль/л?
в)
Будет ли разрушаться комплекс, если
хлорид калия заменить йодидом?
Решение: а)
Пусть [Ag]+
= х. В состоянии равновесия
[Ag(NH3)2]+
↔ Ag+
+2 NH3
(0,1 – х) х
2х
Так как х << 0,1,
концентрация комплексного иона будет
равна примерно 0,1. КН
=
,
4х3
= 6,8 ×10-9;
х =
=
1,2 ×10-3
моль/л
ПРAgCl
= 1×10-10;
ПК = 1,2×10-3×0,1
= 1,2×10-4.
Так как ПК > ПР, осадок выпадет и комплекс
разрушится.
б)
Если увеличить концентрацию аммиака
до 10 моль/л, из выражения для константы
нестойкости найдем: 1×10-8
=
,
х = 1×10-11.
Произведение концентраций ПК = 10-11×10-1
=10-12,
что меньше ПР = 10-10,
следовательно , осадок не выпадет!
в)
ПРAgI
= 1×10-16,
значит ПК > ПР, следовательно, осадок
выпадет, a
комплекс разрушится.
Итак, запомним!
Комплекс разрушится, если
*в раствор введено
вещество, с которым лиганды комплексного
иона связываются более прочно, чем они
были связаны с комплексообразователем:
ПК > ПР;
*происходит
окислительно – восстановительная
реакция:
Zn
+ 2K[Au(CN)2]
= 2Au
+ K2[Zn(CN)4]
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
…
При получении растворов комплексных соединений, происходит их диссоциация на ионы внутренней и внешней сферы. После отщепления внешней сферы (первичная диссоциация), обратимой диссоциации подвергается внутренняя сфера (вторичная диссоциация):
[MLn] ↔ M + nL
Заряды для упрощения опущены, а ионы представлены в негидрированном виде.
Диссоциация комплекса протекает ступенчато, т.е. лиганды удаляются из внутренней сферы последовательно один за другим.
Константа устойчивости и константа нестойкости комплекса
При смешивании двух растворов, содержащих ионы металла и лиганд, произойдет ступенчатое комплексообразование, т.е. последовательное присоединение лиганда к металлу:
| M + L↔[ML] | K1 = [ML]/([M]·[L]) |
| ML + L↔[ML2] | K2 = [ML2]/([ML]·[L]) |
| ……………… | ……………….. |
| MLn-1 + L↔[MLn] | Kn = [MLn]/([MLn-1]·[L]) |
Присоединение лиганда к металлу будет происходить до тех пор, пока количество лигандов не станет равным координационному числу комплексообразователя. Устанавливается динамическое равновесие, при котором происходит как образование комплекса, так и его распад.
Каждой ступени также соответствует свое состояние равновесия, которое характеризуется соответствующей константой равновесия. Константы K1, K2…Kn называют ступенчатыми константами устойчивости (образования) комплексов.
Процесс комплексообразования можно выразить и через так называемые суммарные (кумулятивные) константы устойчивости – βi(обр):
| M + L↔[ML] | β1 = K1 = [ML]/([M]·[L]) |
| M + 2L↔[ML2] | β2 = K1· K2 = [ML2]/([M]·[L]2) |
| ……………… | ……………….. |
| M + nL↔[MLn] | βn = K1· K2·…· Kn = [MLn]/([M]·[L]n) |
Константа βn – общая константа образования комплекса.
Константы устойчивости характеризуют прочность комплекса в растворе, которая увеличивается с ростом их значения.
Процесс диссоциации также можно охарактеризовать с помощью констант, называемых константами нестойкости комплексов:
| [MLn] ↔ MLn-1 + L | Kн1 = 1/Kn = ([MLn-1]·[L])/[MLn] |
| [MLn-1] ↔ MLn-2 + L | Kн2 = 1/Kn-1 = ([MLn-2 ]·[L])/[MLn-1] |
| ……………… | ……………….. |
| [ML] ↔ M + L | Kнn = 1/K1 = ([M]·[L])/[ML] |
Константы Kн1, Kн2… Kнn называют ступенчатыми константами нестойкости (неустойчивости) комплексов. Понятно, что ступенчатые константы нестойкости это обратные величины соответствующих ступенчатых констант устойчивости.
Процесс диссоциации комплекса, также как и процесс комплексообразования, можно охарактеризовать с помощью суммарных равновесий. В этом случае они называются суммарными (кумулятивными) константами нестойкости:
| [MLn] ↔ MLn-1 + L | βн1 = Kн1= ([MLn-1]·[L])/[MLn] |
| [MLn] ↔ MLn-2 + 2L | βнn2 = Kн1· Kн2 = ([MLn-2]·[L]2)/[MLn] |
| ……………… | ……………….. |
| [MLn] ↔ M + nL | βнn = Kн1· Kн2·…· Kнn = ([M]·[L]n)/[MLn] |
Суммарная константа βнn для комплекса MLn называется общей константой нестойкости (неустойчивости) комплекса. Общая константа нестойкости является обратной величиной общей константы устойчивости:
βнn = 1/βn
Как и константа устойчивости, константа нестойкости является количественным показателем устойчивости комплексного соединения в растворе. Прочность комплекса тем больше, чем меньше значение константы нестойкости.
Факторы, влияющие на устойчивость комплекса:
- Внешние факторы: температура, природа растворителя, ионная сила и состав раствора.
- Фундаментальные факторы:
- Природа комплексообразователя, например, устойчивость комплекса [Cu(NH3)2]+ выше, чем устойчивость комплекса [Ag(NH3)2]+, т.е. β2([Cu(NH3)2]+) = 7,2 ·1010 > β2([Ag(NH3)2]+ ) = 1,7· 107. По результатам многих исследований составлен ряд комплексообразователей, в котором устойчивость комплексных соединений, содержащих эти металлы, растет в ряду:
Mn(II) – Fe(II) – Co(II) – Ni(II) – Cu(II).
Природа лиганда и координационное число здесь никакого влияния не оказывают. Данный ряд называют “естественный порядок устойчивости”.
- Природа лигандов, например, устойчивость комплекса [Ag(CN)2]+ выше, чем устойчивость комплекса [Ag(NH3)2]+, т.е. > β2([Ag(NH3)2]+) = 7,1·1019 > β2([Ag(NH3)2]+ ) = 1,7·107.
- Cтерические факторы: хелатный эффект – за счет образования хелатных циклов, полидентантные лиганды образуют более устойчивые комплексы, нежели их монодентантные аналоги.
Стерический эффект — пространственное окружение донорных атомов лиганда, также влияет на устойчивость комплекса.
- Структура лиганда.
Наверное, каждый, кто знаком со школьной химией и интересовался ею хоть немного, знает о существовании комплексных соединений. Это очень интересные соединения с широкими областями применения. Если же вы не слышали о таком понятии, то ниже мы вам всё объясним. Но начнём с истории открытия этого достаточно необычного и интересного вида химических соединений.
История
Комплексные соли были известны ещё до открытия теории и механизмов, позволяющих им существовать. Их назвали по имени химика, который открыл то или иное соединение, и систематических названий для них не было. И, следовательно, нельзя было по формуле вещества понять, какими свойствами оно обладает.
Так продолжалось до 1893 года, пока щвейцарский химик Альфред Вернер не предложил свою теорию, за которую спустя 20 лет и получил Нобелевскую премию по химии. Интересно то, что свои исследования он проводил только с помощью интерпретации различных химических реакций, в которые вступали те или иные комплексные соединения. Сделаны исследования были ещё до открытия электрона Томпсоном в 1896 году, а после этого события, спустя десятки лет, теория была дополнена, в намного более модернизированном и усложнённом виде дошла до наших дней и активно используется в науке для описания явлений, происходящих во время химических превращений с участием комплексов.
Итак, перед тем как перейти к описанию того, что такое константа нестойкости, разберёмся в теории, о которой мы говорили выше.
Теория комплексных соединений
Вернер в своей первоначальной версии координационной теории сформулировал ряд постулатов, которые легли в её основу:
- В любом координационном (комплексном) соединении должен присутствовать центральный ион. Это, как правило, атом d-элемента, реже — некоторые атомы p-элементов, а из s-элементов способен выступать в этом качестве только Li.
- Центральный ион вместе со связанными с ним лигандами (заряженные или нейтральные частицы, например вода или анион хлора) образует внутреннюю сферу комлесного соединения. Она ведёт себя в растворе как один большой ион.
- Внешняя сфера состоит из ионов, противоположных по знаку заряду внутренней сферы. То есть, например, для отрицательно заряженной сферы [CrCl6]3- ионом внешней сферы могут быть ионы металлов: Fe3+, Ni3+ и т. д.
А теперь, если с теорией всё понятно, мы можем перейти к химическим свойствам комплексных соединений и их различиям с обычными солями.
Химические свойства
В растворе комплексные соединения распадаются на ионы, а точнее на внутреннюю и внешнюю сферы. Можно сказать, что они ведут себя как сильные электролиты.
К тому же внутрення сфера тоже может распадаться на ионы, но для того, чтобы это произошло, требуется затратить довольно много энергии.
Внешняя сфера в комплексных соединениях может заменяться другими ионами. Например, если во внешней сфере был ион хлора, а в растворе также присутствует ион, который вместе с внутренней сферой будет давать нерастворимое соединение, или же в растворе есть катион, дающий нерастворимое соединение с хлором, будет происходить реакция замещения внешней сферы.
А теперь, прежде чем перейти к определению того, что такое константа нестойкости, поговорим о явлении, которое напрямую связано с этим понятием.
Электролитическая диссоциация
Вам это слово, наверное, знакомо ещё со школы. Но всё равно дадим определение этому понятию. Диссоциация — это распад молекул растворённого вещества на ионы в среде растворителя. Это происходит благодаря образованию достаточно прочных связей молекул растворителя с ионами растворённого вещества. Например, вода обладает двумя противоположно заряженными концами, и одни молекулы притягиваются отрицательным концом к катионам, а другие — положительным концом к анионам. Так образуются гидраты — ионы, окружённые молекулами воды. Собственно, в этом и состоит суть электролитической диссоциации.
Теперь, собственно, вернемся к основной теме нашей статьи. Что такое константа нестойкости комплексных соединений? Всё достаточно просто, и в следующем разделе мы разберём это понятие подробно и в деталях.
Константа нестойкости комплексных соединений
Этот показатель на самом деле является прямой противоположностью константе устойчиовсти комплексов. Поэтому с неё и начнём.
Если вы слышали про константу равновесия реакции, то легко поймёте нижеизложенный материал. Но а если нет, сейчас мы кратко расскажем об этом показателе. Константа равновесия определяется как отношение концентрации продуктов реакции, возведённых в степени их стехиометрических коэффициентов, к исходным веществам, в которых точно так же учитываются коэффициенты в уравнении реакции. Она показывает, в какую сторону преимущественно пойдёт реакция при той или иной концентрации исходных веществ и продуктов.
Но с чего мы вдруг начали говорить про константу равновесия? На самом деле константа нестойкости и константа устойчивости являются, по сути, константами равновесия соответственно реакций разрушения и образования внутренней сферы комплекса. Связь между ними определяется очень просто: Кн=1/Куст.
Чтобы лучше понять материал, приведём пример. Возьмём комплексный анион [Ag(NO2)2]— и запишем уравнение реакции его распада:
[Ag(NO2)2]— => Ag+ + 2NO2—.
Константа нестойкости комплексного иона этого соединения равна 1,3*10-3. Значит, он достаточно устойчив, но всё же не до такой степени, чтобы считаться очень стабильным. Чем больше устойчивость комплексного иона в среде растворителя, тем меньше константа нестойкости. Формула её может быть выражена через концентрации исходных и реагирующих веществ: Кн=[Ag+]*[2NO2—]2/[[Ag(NO2)2]—].
Теперь, когда мы разобрались с основным понятием, стоит привести немного данных о различных соединениях. В левом столбце написаны названия химических веществ, а в правом — константа нестойкости комплексных соединений.
Таблица
| Вещество | Константа нестойкости |
| [Ag(NO2)2]— | 1.3*10-3 |
| [Ag(NH3)2]+ | 6.8×10-8 |
| [Ag(CN)2]— | 1×10-21 |
| [CuCl4]2- | 2*10-4 |
Более подробные данные по всем известным соединениям приведены в специальных таблицах в справочниках. В любом случае константа нестойкости комплексных соединений, таблица которой для нескольких соединений приведена выше, вряд ли серьёзно поможет вам без использования справочника.
Заключение
После того как мы выяснили, как рассчитать константу нестойкости, остаётся лишь один вопрос — о том, зачем это всё нужно.
Основное назначение этой величины — определение устойчивости комплексного иона. А значит, мы можем предсказать стабильность в растворе того или иного соединения. Это очень помогает во всех сферах, так или иначе связанных с применением комплексных веществ. Приятного изучения химии!