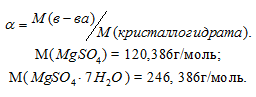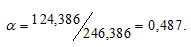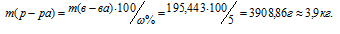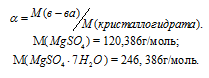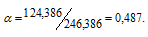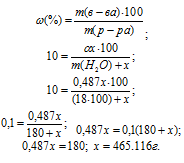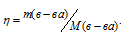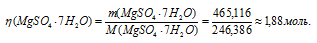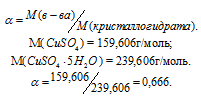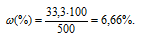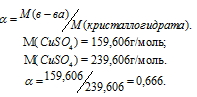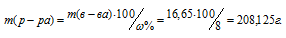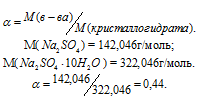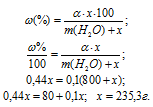поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,663 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,987 -
разное
16,906
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Найдите правильный ответ на вопрос ✅ «Как найти массовую долю CuSO4? …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
готовься долго и много писать(
Вопрос 10.
1)
Дано:
CuSO4
Найти:
ω(S) — ?
ω(Cu) — ?
ω(Ο) — ?
Решение:
Mr(CuSO4) = 64 + 32 + 16 · 4 = 160
ω(Cu) = 64/160 · 100% = 40%
ω(S) = 32/160 · 100% = 20%
ω(O) = 64/160 · 100% = 40%
Ответ: ω(Cu) = 40%; ω(S) = 20%; ω(Ο) = 40%.
2)
Дано:
Fe2O3
Найти:
ω(Fe) — ?
ω(Ο) — ?
Решение.
Mr(Fe2O3) = 56 · 2 + 16 · 3 = 160
ω(Fe) =112/160· 100% = 70%
ω(Ο) = 48/160 · 100% = 30%
Ответ: ω(Fe) = 70%; ω(Ο) = 30%.
3)
Дано:
ΗΝO3
Найти:
ω(Η) — ?
ω(Ν) — ?
ω(Ο) — ?
Решение:
Mr(HNO3) = 1 + 14 + 16 · 3 = 63
ω(Η) = 1/63 · 100% = 1,6%
ω(Ν) = 14/63 · 100% = 22,2%
ω(O) = 48/63 · 100% = 76,2%
Ответ: ω(Η) = 1,6%; ω(Ν) = 22,2%; ω(O) =
76,2%.
Как приготовить раствор соли из её кристаллогидрата
Задача 406.
Для приготовления 5%-ного (по массе) раствора MgSO4 взято 400 г MgSO4 . 7Н2О. Найти массу полученного раствора.
Решение:
Масса растворённого в растворителе вещества и масса кристаллогидрата связаны между собой простым соотношением:
m(в-ва) = 
где 
Тогда
Масса MgSO4 в 400г MgSO4 . 7Н2О будет равна:
m(MgSO4) = 
Для расчета массы раствора используем формулу:

где

Отсюда
Ответ: 3,9кг.
Задача 407.
Сколько молей MgSO4 . 7Н2О надо прибавить к 100 молям воды, чтобы получить 10%-ный (по массе) раствор MgSO4?
Решение:
Масса растворённого в растворителе вещества и масса кристаллогидрата связаны между собой простым соотношением:
m(в-ва) = 
где

Тогда
Для расчета массы кристаллогидрата используем формулу:

где

Обозначим массу кристаллогидрата MgSO4 . 7Н2О через х, а массу MgSO4 через 
Тогда рассчитаем массовую долю MgSO4, подставив соответствующие значения в уравнение, получим
Для расчета количества кристаллогидрата используем формулу:
Отсюда
Ответ: 1,88 моль.
Задача 408.
Определить массовую долю CuSO4 в растворе, полученном при растворении 50г медного купороса CuSO4 . 5H2O в 450г воды
Решение:
Масса растворённого в растворителе вещества и масса кристаллогидрата связаны между собой простым соотношением: m(в-ва) = 

Тогда
Масса раствора равна:
m(CuSO4) = 
Массовую долю CuSO4 находим из уравнения:

где

Отсюда
Ответ: 6,66%.
Задача 409.
В какой массе воды нужно растворить 25г CuSO4 . 5H2O, чтобы получить 8%-ный (по массе) раствор CuSO4?Решение:
Масса растворённого в растворителе вещества и масса кристаллогидрата связаны между собой простым соотношением: m(в-ва) = 

Тогда масса CuSO4, содержащаяся в 25г медного купороса равна:
m(CuSO4) = 
Массу полученного раствора находим из уравнения:

где

Отсюда масса раствора равна:
Тогда масса воды, которую необходимо прибавить к 25 г медного купороса, будет равна:
208,125 – 25 = 183,125г.
Ответ: 183,125г.
Задача 410.
Сколько граммов Na2SO4 . 10H2O надо растворить в 800г воды, чтобы получить 10%-ный (по массе) раствор Na2SO4?
Решение:
Масса растворённого в растворителе вещества и масса кристаллогидрата связаны между собой простым соотношением:
m(в-ва) = 
где 
Для расчета массы кристаллогидрата используем формулу:

где

Обозначим массу кристаллогидрата Na2SO4 . 10H2O через х, а массу Na2SO4 через 
Ответ: 235,3г.
Вычислите массовые доли элементов в процентах по формулам соединений: а) CuSO4 – сульфат меди; б) Fe2O3 – оксид железа; в) HNO3 – азотная кислота.
Массовую долю элемента в соединении находят по формуле:
w (Э) = (Ar (Э) / Mr вещ-ва) * 100%
а) CuSO4 – сульфат меди
Mr (CuSO4) = Ar (Cu) + Ar (S) + 4 * Ar (O) = 64 + 32 + 4 * 16 = 160
w (Cu) = Ar (Cu) / Mr (CuSO4) = 64 / 160 = 0,4 = 40%
w (S) = Ar (S) / Mr (CuSO4) = 32 / 160 = 0,2 = 20%
w (O) = 4 * Ar (O) / Mr (CuSO4) = 4 * 16 / 160 = 0,4 = 40%
Хотя массовую долю последнего элемента всегда можно найти вычитанием из 100% массовых долей всех других элементов:
w (O) = 100 – w (Cu) – w (S) = 100 – 40 – 20 = 40 (%)
б) Fe2O3 – оксид железа
Mr (Fe2O3) = 2 * Ar (Fe) + 3 * Ar (O) = 2 * 56 + 3 * 16 = 112 + 48 = 160
w (Fe) = 2 * Ar (Fe) / Mr (Fe2O3) = 2 * 56 / 160 = 112 / 160 = 0,7 = 70%
w (O) = 3 * Ar (O) / Mr (Fe2O3) = 3 * 16 / 160 = 48 / 160 = 0,3 = 30%
в) HNO3 – азотная кислота
Mr (HNO3) = Ar (H) + Ar (N) + 3 * Ar (O) = 1 + 14 + 3 * 16 = 63
w (H) = Ar (H) / Mr (HNO3) = 1 / 63 = 0,016 = 1,6%
w (N) = Ar (N) / Mr (HNO3) = 14 / 63 = 0,222 = 22,2%
w (O) = 3 * Ar (O) / Mr (HNO3) = 3 * 16 / 63 = 0,762 = 76,2%
1. Вычислите относительную молекулярную массу сульфата меди CuSO4.
2. Вычислите массовые отношения элементов в угольной кислоте, химическая формула которой H2CO3.
4. Во сколько раз массовая доля химического элемента серы в оксиде серы SO3 меньше, чем в оксиде серы SO2?
5. Водород соединяется с серой в массовых отношениях 1 : 16. Используя данные об относительных атомных массах этих элементов, выведите химическую формулу сероводорода.
6. Применяя сведения об относительных атомных массах химических элементов, составьте химическую формулу сульфата меди, если массовые отношения в нем меди, серы и кислорода соответственно равны 2 : 1 : 2.
7. Выведите простейшую формулу соединения, в котором массовая доля натрия равна 32,4%, серы — 22,5%, кислорода — 45,1%.
8. Смешали 14 г порошкообразного железа с 14 г порошкообразной серы. Смесь нагрели. Найдите массу сульфида железа, если известно, что Fe и S в данном случае соединяются в массовых отношениях 7 : 4.
Тестовые задания.