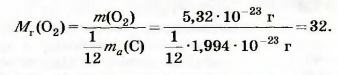Вычисление масс ионов
По этой ссылке вы найдёте полный курс лекций по математике:
Пример !. Вычислить массу ионов К+ и SOT», содержа-щихся в 1,20 4 2М раствора сульфата калия KjSO*. Решение. Концентрация ионов в растворе равна произведению молярности раствора на степень диссоциации электролита и на число ионов, получаемых при диссоциации молекулы. В математической форме это можно выразить так: где п — число ионов, получаемых при диссоциации одной молекулы. Уравнение диссоциации: KaS04 = 2К+ + SOJ-
Сульфат калия относится к сильным электролитам, диссоциирующим в водном растворе почти полностью. Поэтому степень диссоциации его можно принять равной 1. В соответствии с этим Ск+ = 2М • 2 = 4М; Cso,«- = = 2М . 1 2М- |1К+ = 39 г/ион; psot— = 96 г/ион. Отсюда г/ион • 4 г-ион/л . 1,20 л 155 г т$о- « 96 е/г-ион • 2 г-ион/л • 1,20 л =» 225,2 г Пример 2. Степень диссоциации Н£Оз по первой ступени равна 1%. Вычислить массу ионов Н+ и НСО~ в 2 л 0,006М раствора. Решение.
Вычисление масс ионов цнсо,- =» 61 г/е-ион; тном ртяш.
Возможно вам будут полезны данные страницы:
См • * • п mH+ = 1 г/г-ион • 0,006 е-ион1л • 0,01. 2 л = = 0,00012 г = 12 . 10-* г тнсо-« 61 г/г-ион — 0,006 гчюн/л • 0,01 • 2 л — = 0,00732 г — 7,32 • 10-3 г Вычисление количества ионов, содержащихся в данном объеме раствора. Грамм-ион содержит такое же число ионов, как грамм-молекула-—молекул и грамм-атом — атомов, т. е. 6,02 • 104
Пример. В 1 м9 воды внесли каплю 0,Ш раствора хлорида магния. Определить, сколько ионов оказалось в капле полученного раствора. Принять, что в 1 мл содержится 30 капель. Решение. Сколько молей хлорида магния MgQs содержалось в 1 мл 0,Ш раствора: Сколько молей хлорида магния MgQa содержалось в 1 капле 0,1 М раствора:
Сколько молекул хлорида магния
содержалось в 1 капле 0,1 М раствора: = 6,02 • 10» • 3,33 . 10-« « 20 • 10»’ молекул Сколько молекул хлорида магния содержалось в 1 мл разбавленного раствора: tj= 90[Jf ~ 20, 10″ молекул Сколько молекул содержалось в 1 капле разбавленного раствора: Вычисление масс ионов Сколько ионов Mg®+ и С1- содержалось в 1 капле разбавленного раствора. Так как из одной молекулы хлорида магния MgCla получаются 1 ион Mg*+ и 2 иона С1~, то ионов Mg*+ будет столько же, сколько молекул MgCl,, а ионов Q-в 2 раза больше:
There are many known compounds and molecules. The compounds made up only of ions are called ionic compounds. The concept of the formula unit of ionic compounds and the formula mass helps find the atomic masses of the ionic compounds. The formula mass is then calculated in the same way in which the molecular mass is calculated. Since the electrons that transform an atom into an ion have negligible mass, the atomic mass of an atom and its ion is identical. Since the formula for an ionic compound does not describe the composition of a discrete molecule, the term “molecular mass” may not be appropriate.
What Are Ionic Compounds?
Ionic compounds are those that are made up entirely of ions. The strong electrostatic forces of attraction hold the positively charged ions known as cations and negatively charged ions known as anions together in an ionic compound.
Ionic bonds, also known as electrovalent bonds, are the forces that hold the ions in an ionic molecule together. The overall charge of an ionic compound is zero because it is made up of an equal number of positive and negative ions.
For example- Potassium chloride is an ionic compound composed of an equal amount of positively charged potassium ions (K+) and negatively charged chloride ions (Cl–).
Some of the common ionic compounds, their formulae, and the ions present in them are shown in the following table.
|
Name |
Formulae |
Ions present |
|
Sodium chloride |
NaCl |
Na+ and Cl– |
|
Ammonium chloride |
NH4Cl |
NH4+ and Cl– |
|
Magnesium chloride |
MgCl2 |
Mg2+ and Cl– |
|
Potassium chloride |
KCl |
K+ and Cl– |
|
Calcium chloride |
CaCl2 |
Ca2+ and Cl– |
|
Magnesium oxide |
MgO |
Mg2+ and O2- |
|
Calcium oxide |
CaO |
Ca2+ and O2- |
|
Aluminium oxide |
Al2O3 |
Al3+ and O2- |
What is the Formula Unit of Ionic Compounds?
An ionic compound is made up of a large number of positively and negatively charged ions that have been bonded together. Since sodium chloride is an ionic compound containing a large but equal amount of sodium ions (Na) and chloride ions (Cl), the actual formulae of sodium chloride compound should be (Na+)n(Cl–)n or (Na+Cl–)n, where n is a very large number. The simplest formula for sodium chloride is NaCl, which is not the actual formula.
A formula unit of ionic compounds is the simplest combination of ions that produces an electrically neutral unit. An ionic compound’s formula unit can be considered as the smallest unit of that compound, it is equivalent to a molecule of that compound.
For example:
- NaCl is the formula unit for sodium chloride, which is made up of one Na+ ion and one Cl– ion.
- (NH4)2SO4 is the formula unit for ammonium sulphate. There are two NH4+ ions and one SO42- ion in it.
- Calcium nitrate has the formula Ca(NO3)2. It consists of one Ca2+ ion and two NO3– ions.
What is Formula Mass?
Since ionic compounds are not made up of molecules, using the term ‘molecular mass’ for them is inaccurate. As a result, we refer to ionic compounds that lack individual molecules as ‘formula mass.’
The formula mass of an ionic compound is the sum of the atomic masses of the atoms or ions represented by its formula in comparison to the mass of a carbon-12 atom taken as 12 units, i.e., the formula mass is the sum of the atomic masses of the atoms or ions represented by its formula.
The sum of the atomic weights of the atoms in the empirical formula of the compound is the formula mass, also known as formula weight. The mass is expressed in atomic mass units (amu) or (u). Ionic compounds are made up of discrete cations and anions that are mixed in specific ratios to produce electrically neutral bulk matter. To determine the formula mass of an ionic compound, we need to know the ionic compound’s formula as well as the atomic masses of all the atoms or ions in the formula.
For example- Consider the chemical name for typical table salt, sodium chloride, or NaCl. The ionic compound sodium chloride is made up of sodium cations, Na+, and chloride anions, Cl–, in a 1:1 ratio. Since Na has an atomic mass of 23 u and Cl has an atomic mass of 35.5 u, the formula mass for NaCl is 23+35.5=58.5 u. This calculation used the average masses of neutral sodium and chlorine atoms rather than the masses of sodium cations and chloride anions. When computing the formula mass of an ionic compound, this method is completely appropriate. Even though a sodium cation has a slightly lower mass than a sodium atom (due to the absence of an electron), the fact that a chloride anion is slightly more massive than a chlorine atom will compensate for this discrepancy (due to the extra electron).
Furthermore, in comparison to the mass of a normal atom, the mass of an electron is negligibly small. Even when calculating the mass of an isolated ion, the missing or extra electrons can usually be ignored because their contribution to the overall mass is insignificant, represented only in the non-significant digits that will be lost when the computed mass is properly rounded. Very light ions produced from elements with precisely determined atomic masses are the only exceptions to this rule.
Solved Questions
Question 1: Write the name of the given compound Al2(SO4)3. Also, mention the ions present in it
Answer:
The given compound is called aluminium sulphate. The ions present in it are Al3+ and SO42-.
Question 2: Calculate the formula mass of potassium carbonate K2CO3. Given atomic masses K=39u, C=12u and O=16u.
Answer:
Formulas mass of K2CO3 = Mass of 2 K atoms + Mass of 1 C atom + Mass of 3 O atoms
=2×(39) + 12 + 3×(16)
=78 + 12 + 48
=138 u
So the formula mass of potassium carbonate is 138 u.
Question 3: What is the relationship between the mass of an atom and the formula mass?
Answer:
The formula mass is the sum of the atomic masses of the atoms in the formula.
Question 4: Calculate the formula mass of sodium oxide Na2O. Given atomic masses N=23u, and O=16u.
Answer:
Formulas mass of Na2O = Mass of 2 Na atoms + Mass of 1 O atoms
= 2 × (23) + 16
= 46 + 16
= 62 u
So the formula mass of sodium oxide is 62 u.
Question 5: The ions present in the compound are K+ and NO3–. Write the name and the formula of the compound represented by the given ions.
Answer:
The ions present are, one ion of potassium (K+) and one ion of nitrate (NO3–). So, the formula becomes KNO3 and its name is potassium nitrate.
Question 6: Why does the chloride ion have a negative charge (Cl–)?
Answer:
Since it has more electrons than a neutral atom, so the chloride ion has a negative charge.
Last Updated :
29 Oct, 2021
Like Article
Save Article
Как найти массу иона?
Формулу).
Вопрос Как найти массу иона?, расположенный на этой странице сайта, относится к
категории Химия и соответствует программе для 5 — 9 классов. Если
ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска
похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему.
Для этого ключевые фразы введите в строку поиска, нажав на кнопку,
расположенную вверху страницы. Воспользуйтесь также подсказками посетителей,
оставившими комментарии под вопросом.
Как определить число ионов
Ион – это электрически заряженная частица. Она образуется, когда атом или молекула притягивает к себе дополнительные электроны или же отдает свои. Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами. Частицы образуются в растворах в ходе процесса, который называется электролитической диссоциацией. Но это может происходить и при воздействии высокой температуры, электрического тока и т.д. При диссоциации даже крохотного количества вещества образуется определенное число ионов.

Инструкция
Поставлена следующая задача: имеется 40 г поваренной соли. Ее растворили в воде. Сколько ионов при этом образовалось, если допустить, что все атомы поваренной соли подверглись диссоциации?
Напишите формулу этого вещества: NaCl. Посчитайте его молекулярную массу, сложив атомные веса натрия и хлора: 23 + 35,5 = 58,5 а.е.м. (атомных единиц массы). Поскольку молярная масса любого вещества численно равна его молекулярной массе, только выражается в другой размерности (г/моль), то 1 моль поваренной соли (хлористого натрия) будет весить приблизительно 58,5 г.
Вычислить, сколько молей хлористого натрия содержится в 40 г. Произведите деление: 40/58,5 = 0,6838 , или 0,68 моля.
Воспользуйтесь универсальным числом Авогадро, которое равно 6,022*10^23. Это количество элементарных частиц – молекул, атомов или ионов, содержащихся в одном моле любого вещества. В вашем случае до диссоциации хлористый натрий состоял из молекул. Следовательно, в 1 моле этого вещества содержится примерно 6,022*10^23 его молекул. Но у вас 0,68 моля. Произведите умножение: 0,68*6,022*10^23 = 4,095*10^23. Вот столько молекул содержится в 40 г хлористого натрия.
При диссоциации каждая молекула поваренной соли образует два иона: положительно заряженный ион натрия и отрицательно заряженный ион хлора. Поэтому, умножьте полученный результат на 2: 2*4,095*10^23 = 8,19*10^23. Вот столько ионов образовалось при диссоциации 40 г поваренной соли. Задача решена.
Полезный совет
По точно такому же алгоритму можно определить количество ионов любого вещества, принимая во внимание следующие условия:
— вещество должно быть растворимым;
— учитывайте индексы катионов и анионов. Например, при подсчете количества ионов сульфата калия – К2SO4, помните, что каждая его молекула образует три иона.
Источники:
- молекула поваренной соли
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Гипермаркет знаний>>Химия>>Химия 7 класс>> Относительная молекулярная и относительная формульная массы
Относительная молекулярная и относительная формульная массыМатериал параграфа поможет вам:
> выяснить, что такое относительная молекулярная масса и относительная формульная масса;
> правильно вычислять относительные молекулярные и формульные массы.
Относительная молекулярная масса.
Массы молекул, как и атомов, чрезвычайно малы. Поэтому в химии используют относительные массы молекул. Их еще называют относительными молекулярными массами.
Относительная молекулярная масса — это отношение массы Молекулы к 1/12 массы атома Карбона.
Относительную молекулярную массу сокращенно обозначают Mr. Эта величина, как и относительная атомная масса, не имеет размерности.
Математическая формула для ее вычисления, исходя из массы молекулы:
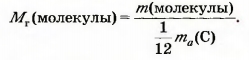
Найдем относительную молекулярную массу кислорода, использовав массы молекулы кислорода (5,32 • 10-23 г) и атома Карбона (1,994 • 10-23 г):
Значительно проще вычислять относительную молекулярную массу, используя относительные атомные массы.
Относительная масса молекулы равна сумме относительных масс атомов, которые входят в ее состав.
Найдем относительные молекулярные массы кислорода и воды, взяв из периодической системы Менделеева значения относительных атомных масс Оксигена и Гидрогена:
Mr(O2) = 2Аr(0) = 2 • 16 = 32;
Mr(H2O) = 2Ar(H) +Ar(O) = 2 • I + 16 = 18.
► Вычислите относительные молекулярные массы азота N2 и аммиака NH3.
Это интересно
Наименьшую массу имеют ионы Гидрогена H+ и H— .
Относительная формульная масса.
Для ионов, а также веществ с атомным и ионным строением (они не содержат молекул) вместо термина «относительная молекулярная масса» используют другой «относительная формульная масса». Эту физическую величину обозначают и рассчитывают так же, как и относительную молекулярную массу.
Относительная формульная масса иона. Масса простого иона почти не отличается от массы соответствующего атома, так как ион содержит наодин или несколько электронов больше или меньше, чем атом, а масса электрона в тысячи раз меньше массы атома. Совпадают также относительные формульные массы простых ионов и относительные атомные массы элементов:
Mr(K+) = Ar(K); Mr(O2- ) = Ar(O).
Относительные формульные массы сложных ионов можно рассчитать тем же способом, что и относительные молекулярные массы:
Mr(CO2-3 ) =Ar (C ) + ЗАr(0) = 12 + 3 • 16 = 60.
► Вычислите относительные формульные массы ионов NH+4 и NO—2.
Это интересно
Значение относительной формульной массы 100 имеют соединения с Формулами
CrO3, Mg3N2, CaCO3.
Относительная формульная масса ионного вещества. Вычисление относительной формульной массы поваренной соли осуществляют так:
Mr(NaCl) =A r(Na) +Ar(Cl) = 23 + 35,5 = 58,5.
В качестве другого примера возьмем алюминий сульфат Al2(SO4)3. Это соединение состоит из простых ионов Al3+ и сложных ионов SO4— .
Относительную формульную массу соединения можно вычислить двумя способами.
1 способ. Используем относительные атомные массы:
Mr[Al2(SO4)3] = 2Ar(Al) + 3Ar(S) + 3 • 4Аr(0) = 2 • 27 + 3 • 32 + 12 • 16 = 342.
2 способ. Используем относительные формульные массы ионов:
Mr(Al3+) =A r(Al) =27;
Mr(SO2-4) = Ar(S) + 4Аr(0) = 32 + 4 • 16 = 96;
Mr[Al2(S04)3] = 2Mr(Al3+) + 3Mr(S02-4 ) = 2 • 27 + 3 • 96 = 342.
Относительная формульная масса — это относительная масса формульной единицы вещества.
Понятие «относительная формульная масса» является универсальным. Оно может быть использовано для веществ любого строения, а также для ионов — простых и сложных.
Выводы
Относительная молекулярная масса — это отношение массы молекулы к — массы атома Карбона или сумма относительных масс атомов, которые входят в состав молекулы.
Для ионов, веществ атомного и ионного строения используют относительную формульную массу. Ее обозначают и вычисляют так же, как и относительную молекулярную массу.
?
84. Что такое относительная молекулярная масса? Как ее рассчитать: а) исходя из массы молекулы; б) по химической формуле молекулы?
85. У какого вещества наименьшая относительная молекулярная масса?
86. Вычислите (желательно устно) относительные молекулярные массы веществ, которые имеют такие формулы:
a) Cl2, O3, P4; б) CO, H2S, H3PO4.
87. Рассчитайте относительные формульные массы веществ с такими формулами:
a) CaH2, AIH3; б) Li2O, MgO; в) Cu(OH)2, (NH4 )2S.
88. Во сколько раз масса атома Оксигена больше или меньше массы:
а) молекулы водорода; б) молекулы метана CH4; в) иона Купрума Cu2+; г) иона S02-4? Попробуйте выполнить расчеты устно.
89. Относительная молекулярная масса соединения Хлора с Оксигеном равна 183. В его молекуле — 7 атомов Оксигена. Какова формула вещества?
90. Относительная формульная масса соединения элемента X с Флуором вдвое превышает относительную атомную массу Фосфора. Определите элемент X и напишите формулу соединения.
91. Масса молекулы воды равна 3 • 10-23 г, а атома Карбона — 2 • 10-23 г.
Вычислите по этим данным относительную молекулярную массу воды.
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Содержание урокаконспект урока и опорный каркас
презентация урока
интерактивные технологии
акселеративные методы обучения Практика
тесты, тестирование онлайн
задачи и упражнения
домашние задания
практикумы и тренинги
вопросы для дискуссий в классе Иллюстрации
видео- и аудиоматериалы
фотографии, картинки
графики, таблицы, схемы
комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты Дополнения
рефераты
шпаргалки
фишки для любознательных
статьи (МАН)
литература основная и дополнительная
словарь терминов Совершенствование учебников и уроков
исправление ошибок в учебнике
замена устаревших знаний новыми Только для учителей
календарные планы
учебные программы
методические рекомендации
обсуждения
Идеальные уроки-кейсы
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь — Образовательный форум.
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний — Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов —
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других «взрослых» тем.
Разработка — Гипермаркет знаний 2008-
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: