Random converter
оксид меди (II): состав и молярная масса
Химическая формула
Молярная масса CuO, оксид меди (II) 79.5454 г/моль
63,546+15,9994
Массовые доли элементов в соединении
| Элемент | Символ | Атомная масса | Число атомов | Массовая доля |
|---|---|---|---|---|
| Cuprum | Cu | 63.546 | 1 | 79.887% |
| Oxygenium | O | 15.9994 | 1 | 20.114% |
Использование калькулятора молярной массы
- Химические формулы нужно вводить с учетом регистра
- Индексы вводятся как обычные числа
- Точка на средней линии (знак умножения), применяемая, например, в формулах кристаллогидратов, заменяется обычной точкой.
- Пример: вместо CuSO₄·5H₂O в конвертере для удобства ввода используется написание CuSO4.5H2O.
Калькулятор молярной массы
Моль
Молярная масса
Молярная масса элементов и соединений
Молекулярная масса
Расчет молярной массы
Моль
Все вещества состоят из атомов и молекул. В химии важно точно измерять массу веществ, вступающих в реакцию и получающихся в результате нее. По определению моль является единицей количества вещества в СИ. Один моль содержит точно 6,02214076×10²³ элементарных частиц. Это значение численно равно константе Авогадро NA, если выражено в единицах моль⁻¹ и называется числом Авогадро. Количество вещества (символ n) системы является мерой количества структурных элементов. Структурным элементом может быть атом, молекула, ион, электрон или любая частица или группа частиц.
Постоянная Авогадро NA = 6.02214076×10²³ моль⁻¹. Число Авогадро — 6.02214076×10²³.
Другими словами моль — это количество вещества, равное по массе сумме атомных масс атомов и молекул вещества, умноженное на число Авогадро. Единица количества вещества моль является одной из семи основных единиц системы СИ и обозначается моль. Поскольку название единицы и ее условное обозначение совпадают, следует отметить, что условное обозначение не склоняется, в отличие от названия единицы, которую можно склонять по обычным правилам русского языка. Один моль чистого углерода-12 равен точно 12 г.
Молярная масса
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях. Говоря иначе, это масса одного моля вещества. В системе СИ единицей молярной массы является килограмм/моль (кг/моль). Однако химики привыкли пользоваться более удобной единицей г/моль.
молярная масса = г/моль
Горение — высокотемпературная экзотермическая окислительно-восстановительная реакция.
Молярная масса элементов и соединений
Соединения — вещества, состоящие из различных атомов, которые химически связаны друг с другом. Например, приведенные ниже вещества, которые можно найти на кухне у любой хозяйки, являются химическими соединениями:
- соль (хлорид натрия) NaCl
- сахар (сахароза) C₁₂H₂₂O₁₁
- уксус (раствор уксусной кислоты) CH₃COOH
Молярная масса химических элементов в граммах на моль численно совпадает с массой атомов элемента, выраженных в атомных единицах массы (или дальтонах). Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении. Например, молярная масса воды (H₂O) приблизительно равна 1 × 2 + 16 = 18 г/моль.
Молекулярная масса
Молекулярная масса (старое название — молекулярный вес) — это масса молекулы, рассчитанная как сумма масс каждого атома, входящего в состав молекулы, умноженных на количество атомов в этой молекуле. Молекулярная масса представляет собой безразмерную физическую величину, численно равную молярной массе. То есть, молекулярная масса отличается от молярной массы размерностью. Несмотря на то, что молекулярная масса является безразмерной величиной, она все же имеет величину, называемую атомной единицей массы (а.е.м.) или дальтоном (Да), и приблизительно равную массе одного протона или нейтрона. Атомная единица массы также численно равна 1 г/моль.
Расчет молярной массы
Молярную массу рассчитывают так:
- определяют атомные массы элементов по таблице Менделеева;
- определяют количество атомов каждого элемента в формуле соединения;
- определяют молярную массу, складывая атомные массы входящих в соединение элементов, умноженные на их количество.
Например, рассчитаем молярную массу уксусной кислоты
CH₃COOH
Она состоит из:
- двух атомов углерода
- четырех атомов водорода
- двух атомов кислорода
Расчет:
- углерод C = 2 × 12,0107 г/моль = 24,0214 г/моль
- водород H = 4 × 1,00794 г/моль = 4,03176 г/моль
- кислород O = 2 × 15,9994 г/моль = 31,9988 г/моль
- молярная масса = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Наш калькулятор выполняет именно такой расчет. Можно ввести в него формулу уксусной кислоты и проверить что получится.
Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ.
Другие конвертеры
Конвертеры единиц измерения, используемых при измерении скорости передачи данных, в типографике и обработке изображений, для измерения объема лесоматериалов, а также десятичные приставки и калькулятор молярной массы химических соединений
Вычисление молярной массы
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях, то есть, это масса одного моля вещества.
Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении.
Использование конвертера «Вычисление молярной массы»
На этих страницах размещены конвертеры единиц измерения, позволяющие быстро и точно перевести значения из одних единиц в другие, а также из одной системы единиц в другую. Конвертеры пригодятся инженерам, переводчикам и всем, кто работает с разными единицами измерения.
Пользуйтесь конвертером для преобразования нескольких сотен единиц в 76 категориях или несколько тысяч пар единиц, включая метрические, британские и американские единицы. Вы сможете перевести единицы измерения длины, площади, объема, ускорения, силы, массы, потока, плотности, удельного объема, мощности, давления, напряжения, температуры, времени, момента, скорости, вязкости, электромагнитные и другие.
Примечание. В связи с ограниченной точностью преобразования возможны ошибки округления. В этом конвертере целые числа считаются точными до 15 знаков, а максимальное количество цифр после десятичной запятой или точки равно 10.
Для представления очень больших и очень малых чисел в этом калькуляторе используется компьютерная экспоненциальная запись, являющаяся альтернативной формой нормализованной экспоненциальной (научной) записи, в которой числа записываются в форме a · 10x. Например: 1 103 000 = 1,103 · 106 = 1,103E+6. Здесь E (сокращение от exponent) — означает «· 10^», то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.
Мы работаем над обеспечением точности конвертеров и калькуляторов TranslatorsCafe.com, однако мы не можем гарантировать, что они не содержат ошибок и неточностей. Вся информация предоставляется «как есть», без каких-либо гарантий. Условия.
Если вы заметили неточность в расчётах или ошибку в тексте, или вам необходим другой конвертер для перевода из одной единицы измерения в другую, которого нет на нашем сайте — напишите нам!
Канал Конвертера единиц TranslatorsCafe.com на YouTube
- Относительная молекулярная масса CuO: 79.5454
- Молярная масса CuO: 79.5454 г/моль (0.07955 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| Cu (медь) | 1 | 63.546 | 63.546 |
| O (кислород) | 1 | 15.9994 | 15.9994 |
| 79.5454 |
Расчёт молярной и относительной молекулярной массы CuO
- Mr[CuO] = Ar[Cu] + Ar[O] = 63.546 + 15.9994 = 79.5454
- Молярная масса (в кг/моль) = Mr[CuO] : 1000 = 79.5454 : 1000 = 0.07955 кг/моль
Расчёт массовых долей элементов в CuO
- Массовая доля меди (Cu) = 63.546 : 79.5454 * 100 = 79.886 %
- Массовая доля кислорода (O) = 15.9994 : 79.5454 * 100 = 20.114 %
Калькулятор массы
Вычисление молярной массы
To calculate molar mass of a chemical compound enter its formula and click ‘Compute’. В химической формуле, вы можете использовать:
- Любой химический элемент. Capitalize the first letter in chemical symbol and use lower case for the remaining letters: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы:
NaCl,
Ca(OH)2,
K4[Fe(CN)6],
CuSO4*5H2O,
water,
nitric acid,
potassium permanganate,
ethanol,
fructose.
Molar mass calculator also displays common compound name, Hill formula, elemental composition, mass percent composition, atomic percent compositions and allows to convert from weight to number of moles and vice versa.
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса:
C[14]O[16]2,
S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и). (1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
См. также: молекулярные массы аминокислот
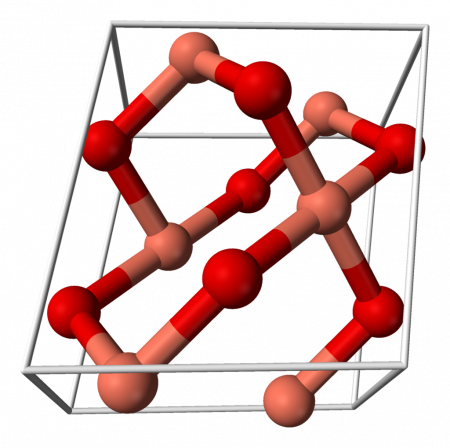
| Оксид меди (II) | |
|---|---|
  |
|
 |
|
| Систематическое наименование |
Оксид меди (II) |
| Хим. формула | CuO |
| Состояние | черный порошок |
| Молярная масса | 79,545 г/моль |
| Плотность | 6,31 г/см³ |
| Температура | |
| • плавления | 1447 |
| • кипения | 2000 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | нерастворим |
| ГОСТ | ГОСТ 16539-79 |
| Рег. номер CAS | [1317-38-0] |
| PubChem | 164827 |
| Рег. номер EINECS | 215-269-1 |
| SMILES |
[O-2].[Cu+2] |
| InChI |
1S/Cu.O/q+2;-2 KKCXRELNMOYFLS-UHFFFAOYSA-N |
| RTECS | GL7900000 |
| ChEBI | 75955 |
| ChemSpider | 144499 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Оксид меди (II) (окись меди) CuO — оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета.
Кристаллическая решётка оксида меди характеризуется следующими параметрами: моноклинная сингония, пространственная группа C2h, параметры ячейки a = 0.46837(5) нм, b = 0.34226(5) нм, c = 0.51288(6) нм, α = 90°, β = 99,54(1)°, γ = 90°. Атом меди окружён четырьмя атомами кислорода и имеет искажённую плоскую конфигурацию.
Получение
Получить оксид меди (II) можно:
- нагревая металлическую медь на воздухе (при температурах ниже 1100 °C):
-
- 2Cu + O2 → 2CuO
- нагревая гидроксид меди (II), её нитрат или карбонат:
-
- 2Cu(NO3)2 → 2CuO + 4NO2 + O2
- CuCO3 → CuO + CO2
- Cu(OH)2 → CuO + H2O
- нагревая малахит:
-
- Cu2CO3(OH)2 →ot 2CuO + CO2 + H2O
Химические свойства
Оксид меди (II) реагирует с кислотами с образованием соответствующих солей меди (II) и воды:
-
- CuO + 2HNO3 → Cu(NO3)2 + H2O
При сплавлении CuO со щелочами образуются купраты:
-
- CuO + 2KOH →ot K2CuO2 + H2O
При нагревании до 1100 °C разлагается на медь и кислород.
Оксиду меди (II) соответствует гидроксид меди (II) Cu(OH)2, который является очень слабым основанием. Он способен растворяться в концентрированных растворах щелочей с образованием комплексов (то есть обладает слабыми амфотерными свойствами):
-
- Cu(OH)2 + 2NaOH → Na2[Cu(OH)4] (тетрагидроксокупрат (II) натрия).
Оксид меди(II) восстанавливается до металлической меди аммиаком, монооксидом углерода, водородом, углем:
-
- CuO + H2 → Cu + H2O
- 2CuO + C → 2Cu + CO2
Физические свойства
Оксид меди (II) относится к моноклинной кристаллической системе.
Работа выхода электрона из кристалла CuO составляет 5,3 эВ.
Оксид меди (II) представляет собой полупроводник p-типа с узкой шириной запрещенной зоны 1,2 эВ.
Оксид меди может быть использован для производства сухих батарей.
Применение
CuO используют при производстве стекла и эмалей для придания им зелёной и синей окраски. Кроме того, оксид меди применяют в производстве медно-рубинового стекла.
В лабораториях применяют для обнаружения восстановительных свойств веществ. Вещество восстанавливает оксид до металлической меди, при этом чёрный цвет оксида меди переходит в розовую окраску меди.
Предмет: Химия,
автор: gasysas
Ответы
Ответ: 96 грамм на моль
Объяснение:
Оксид меди. Cu2O.
Молярная масса равна = 64+16*2=64+32=96 г/моль
davedt55:
В нашем случае с Cu2O. Мы смотрим на цифры которые под порядковым номером элемента.
davedt55:
К примеру,O(кислород) 15,9994. Мы должны его округлить до целых 16
davedt55:
Так и с другими элементами
davedt55:
Cu 63,546 округляем до целых = 64
davedt55:
После того как узнали во эти данные (Забыл название) (Молярная масса вроде бы)
davedt55:
Теперь как в матиматике
davedt55:
Подставляем наши данные в соединение
davedt55:
Cu2O = 64*2+16= 128+16 = 144 г на моль
davedt55:
Я ошибся немного
Интересные вопросы
Предмет: Алгебра,
автор: grekovavalya01
Предмет: Право,
автор: galasoleksandra
Предмет: Алгебра,
автор: artur100500


