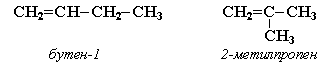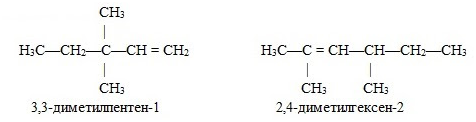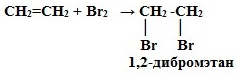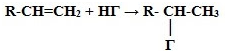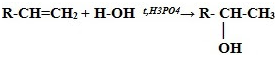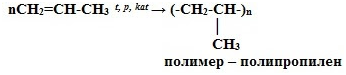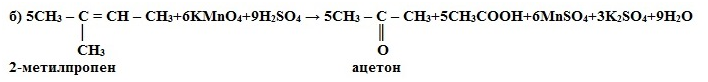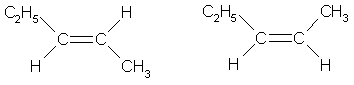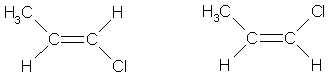Калькулятор молекулярной массы предназначен для расчёта относительной молекулярной массы химических соединений. Для этого достаточно ввести химическую формулу
вещества в соответствующее
поле. При вводе формулы следует соблюдать правильное написание элементов, принятых в химии — то есть первая буква химического элемента долна быть заглавной.
В противном случае могут возникнуть разночтения. Например, если написать формулу как hf, то будет невозможно понять, что
это — HF (фтороводород) или Hf (гафний). При написании формул допускается использование круглых скобок.
Онлайн-калькулятор молекулярной массы
Молекулярные массы некоторых веществ
| Химическое соединение | Относительная молекулярная масса |
|---|---|
| Вода (H2O) | 18.01528 |
| Серная кислота (H2SO4) | 98.07848 |
| Оксид железа(III) (Fe2O3) | 159.6882 |
| Оксид железа(II) (FeO) | 71.8444 |
| Оксид фосфора(V) (P2O5) | 141.944524 |
| Оксид фосфора(III) (P2O3) | 109.945724 |
| Оксид углерода(II) (CO) | 28.0101 |
| Оксид углерода(IV) (CO2) | 44.0095 |
| Кислород (O2) | 31.9988 |
| Этиловый спирт (C2H5OH) | 46.06844 |
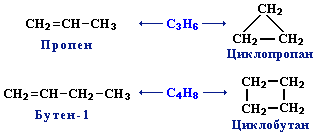
9.5. Непредельные углеводороды. Алкены
(этиленовые УВ)
Алкены, или олефины (от
лат. olefiant — масло — старое название, но широко используемое в химической
литературе. Поводом к такому названию послужил хлористый этилен,
полученный в XVIII столетии, — жидкое маслянист вещество.) — алифатические
непредельные углеводороды, в молекулах которых между углеродными атомами
имеется одна двойная связь.
Алкены
содержат в своей молекуле меньшее число водородных атомов, чем соответствующие
им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды
называют непредельными или ненасыщенными.
Алкены
образуют гомологический ряд с общей формулой CnH2n
Гомологический ряд алкенов
|
СnH2n алкен |
Названия, суффикс ЕН, ИЛЕН |
|
C2Н4 |
этен, этилен |
|
C3H6 |
пропен |
|
C4H8 |
бутен |
|
C5H10 |
пентен |
|
C6H12 |
гексен |
Гомологи:
СH2=CH2 этен
СH2=CH—CH3 пропен
СH2=CH-CH2-CH3 бутен-1
СH2=CH-CH2-CH2—СН3 пентен-1
Физические свойства
Этилен
(этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче
воздуха, малорастворим в воде.
С2 –
С4 (газы)
С5 –
С17 (жидкости)
С18 –
( твёрдые)
· Алкены
не растворяются в воде, растворимы в органических растворителях (бензин, бензол
и др.)
· Легче
воды
· С
увеличением Mr температуры плавления и кипения увеличиваются
Простейшим алкеном является этилен
— C2H4
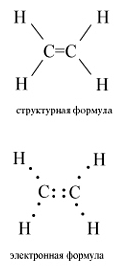
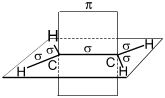
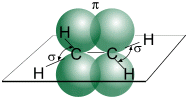
Структурная и электронная формулы
этилена имеют вид:
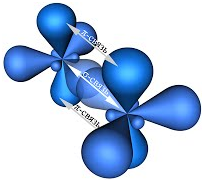
В молекуле
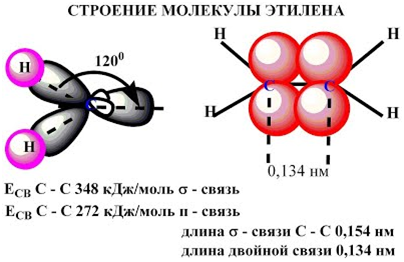
этилена подвергаются гибридизации одна s— и две p-орбитали
атомов C (sp2-гибридизация).
Таким
образом, каждый атом C имеет по три гибридных орбитали и по одной негибриднойp-орбитали.
Две из гибридных орбиталей атомов C взаимно перекрываются и образуют между
атомами C
σ — связь.
Остальные четыре гибридных орбитали атомов C перекрываются в той же плоскости с
четырьмя s-орбиталями атомов H и также образуют четыре σ — связь.
Две негибридные p-орбитали атомов C взаимно перекрываются в
плоскости, которая расположена перпендикулярно плоскости σ — связь, т.е.
образуется одна П — связь.
По своей
природе П — связь резко отличается от σ — связь; П —
связь менее прочная вследствие перекрывания электронных облаков вне плоскости
молекулы. Под действием реагентов П — связь легко разрывается.
Молекула
этилена симметрична; ядра всех атомов расположены в одной плоскости и валентные
углы близки к 120°; расстояние между центрами атомов C равно 0,134 нм.
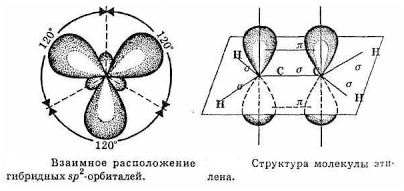
SP2 –гибридизация:
1) Плоское тригональное
строение
2) Угол – HCH — 120°
3) Длина (-С=С-) связи – 0,134
нм
4) Связи — σ, П
5) Невозможно вращение
относительно (-С=С-) связи
Если атомы
соединены двойной связью, то их вращение невозможно без того, чтобы электронные
облака П — связь не разомкнулись.
Изомерия алкенов
Наряду со структурной
изомерией углеродного скелета для алкенов характерны, во-первых,
другие разновидности структурной изомерии — изомерия положения кратной
связи и межклассовая изомерия.
Во-вторых, в
ряду алкенов проявляется пространственная изомерия,
связанная с различным положением заместителей относительно двойной связи,
вокруг которой невозможно внутримолекулярное вращение.
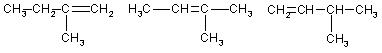
Структурная изомерия алкенов
1. Изомерия углеродного скелета (начиная с С4Н8):
2. Изомерия положения двойной связи (начиная с С4Н8):
3. Межклассовая изомерия с циклоалканами, начиная с С3Н6:
Пространственная изомерия алкенов
Вращение
атомов вокруг двойной связи невозможно без ее разрыва. Это обусловлено
особенностями строения p-связи (p-электронное облако сосредоточено над и под
плоскостью молекулы). Вследствие жесткой закрепленности атомов поворотная
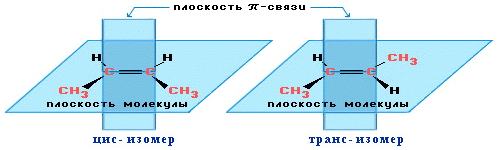
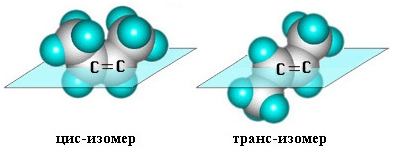
изомерия относительно двойной связи не проявляется. Но становится возможной цис—транс-изомерия.
Алкены,
имеющие у каждого из двух атомов углерода при двойной связи различные
заместители, могут существовать в виде двух пространственных изомеров,
отличающихся расположением заместителей относительно плоскости p-связи. Так, в
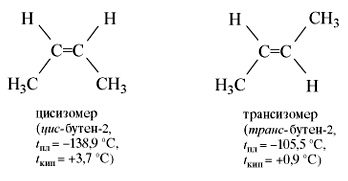
молекуле бутена-2СН3–СН=СН–СН3 группы СН3 могут
находиться либо по одну сторону от двойной связи вцис -изомере,
либо по разные стороны в транс-изомере.
ВНИМАНИЕ! цис-транс— Изомерия не проявляется, если хотя
бы один из атомов С при двойной связи имеет 2 одинаковых заместителя.
Например,
бутен-1 СН2=СН–СН2–СН3 не
имеет цис— и транс-изомеров, т.к. 1-й атом С связан с
двумя одинаковыми атомами Н.
Изомеры цис— и транс—
отличаются не только физическими
,
но и
химическими свойствами, т.к. сближение или удаление частей молекулы друг от
друга в пространстве способствует или препятствует химическому взаимодействию.
Иногда цис-транс-изомерию
не совсем точно называют геометрической изомерией. Неточность
состоит в том, что все пространственные изомеры различаются
своей геометрией, а не только цис— и транс-.
Номенклатура
Алкены
простого строения часто называют, заменяя суффикс -ан в алканах на -илен:
этан — этилен, пропан — пропилен и т.д.
По
систематической номенклатуре названия этиленовых углеводородов производят
заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен,
этан — этен, пропан — пропен и т.д.). Выбор главной цепи и порядок названия тот
же, что и для алканов. Однако в состав цепи должна обязательно входить двойная
связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта
связь. Например:
Непредельные
(алкеновые) радикалы называют тривиальными названиями или по систематической
номенклатуре:
(Н2С=СН—
) винил или этенил
(Н2С=CН—СН2 ) аллил
Физические
свойства некоторых
алкенов показаны в табл. 1. Первые три представителя гомологического ряда
алкенов (этилен, пропилен и бутилен) — газы, начиная с C5H10(амилен,
или пентен-1) — жидкости, а с С18Н36 — твердые
вещества. С увеличением молекулярной массы повышаются температуры плавления и
кипения. Алкены нормального строения кипят при более высокой температуре, чем
их изомеры, имеющие изостроение. Температуры кипения цис-изомеров
выше, чем транс-изомеров, а температуры плавления — наоборот.
Алкены плохо
растворимы в воде (однако лучше, чем соответствующие алканы), но хорошо — в
органических растворителях. Этилен и пропилен горят коптящим пламенем.
Таблица 1. Физические свойства
некоторых алкенов
|
Название |
Формула |
t пл,°С |
t кип,°С |
|
Этилен |
С2Н4 |
-169,1 |
-103,7 |
|
Пропилен |
С3Н6 |
-187,6 |
-47,7 |
|
Бутилен |
C4H8 |
-185,3 |
-6,3 |
|
Цис-бутен-2 |
С4Н8 |
-138,9 |
3,7 |
|
Транс-бутен-2 |
С4Н8 |
-105,5 |
0,9 |
|
Изобутилен |
С4Н8 |
-140,4 |
-7,0 |
|
Амилен |
C5H10 |
-165,2 |
+30,1 |
|
Гексилен |
С6Н12 |
-139,8 |
63,5 |
|
Гептилен |
C7H14 |
-119 |
93,6 |
|
Октилен |
C8H16 |
-101,7 |
121,3 |
|
Нонилен |
C9H18 |
-81,4 |
146,8 |
|
Децилен |
С10Н20 |
-66,3 |
170,6 |
Химические свойства алкенов
Для алкенов
наиболее типичными являются реакции присоединения. В реакциях присоединения
двойная связь выступает как донор электронов, поэтому для алкенов характерны
реакции электрофильного присоединения.
1. Гидрирование (гидрогенизация – взаимодействие с
водородом):
CnH2n + H2 t, Ni → CnH2n+2
2. Галогенирование (взаимодействие с галогенами):
CnH2n + Г2 → СnH2nГ2
Это качественная реакция алкенов –
бромная вода Br2 (бурая жидкость) обесцвечивается.
3.
Гидрогалогенирование* (взаимодействие
с галогенводородами):
4. Гидратация* (присоединение молекул воды):
CH2=CH2 + H2O t,H3PO4→ CH3—CH2—OH
(этанол – этиловый спирт)
* Присоединение галогенводородов и воды
к несимметричным алкенам происходит поправилу Марковникова В.В.
Присоединение водорода происходит к
наиболее гидрированному атому углерода при двойной углерод-углеродной связи.
Исключения!!!
1) Если в алкене присутствует
электроноакцепторный заместитель, т.е. группа, способная оттягивать на себя
электронную плотность:
F3C ← CH=CH2 + H—Br → F3C — CH2 — CH2(Br) 1,1,1-
трифтор-3-бромпропан
2) Присоединение в присутствии Н2О2 (эффект
Хараша) или органической перекиси (R—O—O—R ):
СH3-CH=CH2 + H-Br Н2О2 → H3C
— CH2 — CH2(Br)
5. Реакции полимеризации:
nCH2=CH2 t, p, kat-TiCl4, Al(C2H5)3 → (-CH2-CH2-)n
мономер —
этилен
полимер – полиэтилен
1. Горение:
CnH2n + 3n/2O2 t, p, kat → nCO2 + nH2O + Q (пламя
ярко светящее)
Частичное окисление этилена
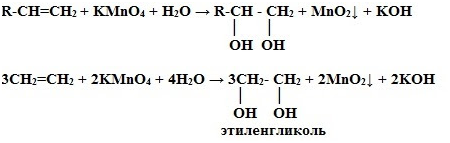
2. Окисление
перманганатом калия (р. Вагнера) в нейтральной среде– это качественная реакция
алкенов, розовый раствор марганцовки обесцвечивается.
Влияние среды на характер продуктов реакций окисления
1) Окисление
в кислой среде при нагревании идёт до а) карбоновых кислот; б) кетонов
(если атом углерода при двойной связи содержит два заместителя); в) углекислого
газа (если двойная связь на конце молекулы, то образуется муравьиная кислота,
которая легко окисляется до CO2):
а) 5CH3-CH=CH-CH3 + 8KMnO4 + 12H2SO4 →
10CH3COOH + 8MnSO4 +4K2SO4 +
12H2O
в) CH3 –
CH2 – CH = CH2 + 2KMnO4 +
3H2SO4 → CH3CH2COOH + CO2 +
2MnSO4 + K2SO4 + 4H2O
2) Окисление в нейтральной
или слабощелочной среде на холоде
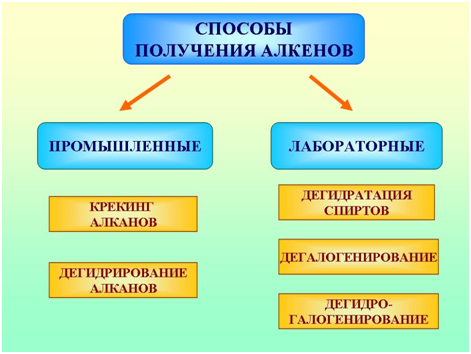
Получение в промышленности
|
1. Крекинг Основным промышленным источником получения первых CnH2n+2 t, |
|
2. Дегидрирование CnH2n+2 t, kat—Ni или (Cr2O3)→ CnH2n +H2 |
|
3. Гидрирование CnH2n-2 + H2 t, kat-(Pt или Pd, Ni) → CnH2n |
Получение в лаборатории
|
1. Дегидратация* R—CH2—CH2—OH t>140°C, H2SO4(конц.)→ R—CH=CH2 + H2O *Правило Отрыв атома водорода происходит от |
|
2. Дегидрогенирование* |
|
3. Дегалогенирование |
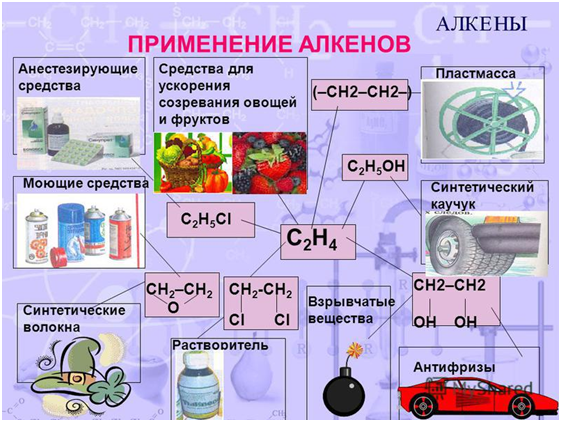
Применение
Алкены
широко используются в промышленности в качестве исходных веществ для получения
растворителей (спирты, дихлорэтан, эфиры гликолей и пр.), полимеров
(полиэтилен, поливинилхлорид, полиизобутилен и др.), а также многих других
важнейших продуктов.
УПРАЖНЕНИЯ
1. 10,5 г некоторого алкена способны присоединить 40 г
брома. Определите неизвестный алкен.
Решение:
Пусть
молекула неизвестного алкена содержит n атомов углерода. Общая формула
гомологического ряда CnH2n. Алкены реагируют с бромом в
соответствии с уравнением:
CnH2n + Br2 = CnH2nBr2.
Рассчитаем
количество брома, вступившего в реакцию: M(Br2) = 160 г/моль. n(Br2)
= m/M = 40/160 = 0,25 моль.
Уравнение
показывает, что 1 моль алкена присоединяет 1 моль брома, следовательно, n(CnH2n)
= n(Br2) = 0,25 моль.
Зная
массу вступившего в реакцию алкена и его количество, найдем его молярную массу:
М(CnH2n) = m(масса)/n(количество) = 10,5/0,25 = 42
(г/моль).
Теперь
уже совсем легко идентифицировать алкен: относительная молекулярная масса (42)
складывается из массы n атомов углерода и 2n атомов водорода. Получаем
простейшее алгебраическое уравнение:
12n
+ 2n = 42.
Решением
этого уравнения является n = 3. Формула алкена: C3H6.
__________________________________________________________________
2. С помощью каких химических реакций
можно очистить пропан от примеси пропена.
Решение:
Пропен можно поглотить бромной водой:
СН3-СН=СН2 + Вr2 → СН3-СНВr-СН2Вr
или водным раствором перманганата калия:
СН3-СН=СН2 + [О] + Н2О → СН3-СН(ОН)-СН2ОН.
Пропан с этими веществами не реагирует и
улетучивается.
__________________________________________________________________
3. Этиленовый углеводород массой 7,0 г
присоединяет 2,24 л (н.у.) бромоводорода. Определите молярную массу и строение
этого углеводорода, если известно, что он является цис-изомером.
Решение:
Этиленовые углеводороды присоединяют бромоводород по
уравнению:
CnH2n + HBr → CnH2n+1Br.
v(HBr) = 2,24/22,4
= 0,1 моль. v(CnH2n)
= v(HBr) = 0,1 моль.
M(CnH2n) = 7,0/0,1 = 70 г/моль, следовательно, n = 5. Существует 5 структурных изомеров этиленовых
углеводородов состава С5Н10:
СН3-СН2-СН2-СН=СН2
СН3-СН2-СН=СН-СН3
пентен-1
пентен-2
2-метилбутен-1
2-метнлбутен-2 З-метилбутен-1
Из этих веществ только пентен-2 имеет
цис-транс-нзомеры:
транс-пентен-2
цис-пентен-2
Ответ. Цис-пентен-2.
__________________________________________________________________
4. Сколько существует индивидуальных
веществ состава С3Н5Сl.
обесцвечивающих бромную воду? Приведите структурные формулы молекул этих
веществ.
Решение:
С3Н5Сl — это монохлорпроизводное от углеводорода С3Н6.
Это вещество обесцвечивает бромную воду, следовательно, имеет в своем составе
двойную связь. Три атома углерода могут образовать только неразветвленный
углеродный скелет с концевой двойной связью:
С-С = С.
Структурная изомерия возможна только за счет положения
атома хлора относительно двойной связи:
СН3-СН = СНСl СН3-ССl = СН2
Сl-СН2-СН = СН2
1-хлорпропен
2-хлорпропен
3-хлорпропен
1-хлорпропен может существовать в виде
цис-транс-изомеров:
транс-1
–хлорпропен
цис -1-хлорпропен
Ответ. 4 изомера.
__________________________________________________________________
5. При взаимодействии 11,2 л (н.у.) смеси
изомерных углеводородов, представляющих собой газы с плотностью по водороду
21, с бромной водой получено 40,4 г соответствующего дибромпроизводного.
Определите строение этих углеводородов и содержание каждого из них в смеси (в %
по объему).
Решение:
Молярная масса изомерных углеводородов равна: M(СхНу) = 21*2 = 42 г/моль,
следовательно, углеводороды имеют формулу С3Н6. Такую
молекулярную формулу имеют два вещества — пропен и циклопропан. Пропен
реагирует с бромной водой:
СН3 —
СН = СН2 + Вr2 → СН3 –
СНВr — СН2Вr.
Молярная масса дибром производного равна: М(С3Н6Вr2) = 202
г/моль, а его количество: v(C3H6Br2) = 40,4/202 = 0,2 моль. Следовательно, в исходной
смеси было 0,2 моль пропена. Общее количество углеводородов в смеси было равно
11,2/22,4 = 0,5 моль; оставшиеся 0,3 моль приходятся на долю циклопропана,
который не взаимодействует с бромной водой.
Объемные доли газов в смеси равны их мольным долям: j( пропена) = 0,2/0,5 = 0,4, или 40%, j (циклопропана)
= 0,6, или 60%,
Ответ. 40% пропена, 60% циклопропана.
__________________________________________________________________
6. При пропускании алкена через избыток
раствора перманганата калия масса выпавшего осадка оказалась в 2,07 раза больше
массы алкена. Установите формулу алкена.
Решение:
Алкены окисляются водным раствором перманганата калия
по общему уравнению:
ЗСnН2n + 2KМnO4 +
4Н2O = 3CnH2n(OH)2 + 2MnO2↓ + 2KOH.
Из 3 моль алкена (массой 3-(12n+2n) = 42n) образуется 2 моль МnО2 (массой
2*87 = 174 г). По условию задачи
42n –2,07=
174,
откуда n = 2. Искомый алкен — этилен. С2Н4.
Ответ. С2Н4.
__________________________________________________________________
7.
__________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Какое
соединение получится при обработке этилового спирта концентрированной серной
кислотой при 160 °С? Напишите уравнения реакций и назовите соединения по
рациональной и ИЮПАК номенклатурам.
2. Какое
соединение получится при обработке изобутилового спирта концентрированной
серной кислотой при 160 °С? Напишите уравнения реакций и назовите
соединения по рациональной и ИЮПАК номенклатурам.
3. Какие
углеводороды ряда этилена получаются при каталитическом дегидрировании
н-бутана? Напишите уравнения реакций и назовите соединения по рациональной и
ИЮПАК номенклатурам.
4.
Нагреванием 200 г нормального йодистого бутила со спиртовой щелочью
получено 6,5 л бутена-1 (объем газа указан при нормальных условиях). Каков
был выход продукта в процентах от теоретического?
5. Укажите,
из какого йодистого алкила при нагревании со спиртовым раствором едкого кали
может быть получен: а) изобутилен; б) пентен-2; в) тетраметилэтилен; г)
гексен-3. Напишите уравнения реакций и назовите соединения по рациональной и
ИЮПАК номенклатурам.
6. Какие
предельные углеводороды образуются при каталитическом гидрировании следующих
соединений: а) пропилена; б) несимм-диметилэтилена
(несимметрично замещенного диметилэтилена); в) 3,5-диметилгептена-3?
7. Какое
количество водорода (в литрах) при нормальных условиях присоединят в
присутствии катализатора: а) 11,2 л этилена; б) 2,24 л пентадиена
1,3?
8. Какие
соединения образуются при действии раствора перманганата калия на холоду
(20 °С) на следующие углеводороды: а) тетраметилэтилен; б) изобутилен? Напишите
уравнения реакций.
9. Сколько
граммов брома могут присоединить смеси: а) 3,5 г пентена-1 + 10 г
пентана; б) 10,5 г пентена-2 + 7 г децена-2; в) 100 г смеси,
состоящей из 72 % декана и 28 % октена-2.
10. Напишите
уравнения реакций, соответствующих переходу (в несколько стадий, используя
любые неорганические реагенты): CH3-CH2-CH=CH2 a CH3-CH=CH-CH3.
Назовите все соединения по ИЮПАК.
|
1. Как |
|
|
а) возрастает |
б) уменьшается |
|
в) не изменяется |
г) изменяется случайным образом |
|
2. Бромэтан может быть превращен в этилен: |
|
|
а) взаимодействием с натрием |
б) взаимодействием со спиртовым |
|
в) нагреванием с серной кислотой |
г) взаимодействием с водородом |
|
3. Укажите значение относительной молекулярной массы |
|
|
а) 86 |
б) 84 |
|
в) 82 |
г) 80 |
|
4. Реакция присоединения воды называется реакцией: |
|
|
а) гидрирования |
б) дегидратации |
|
в) гидратации |
г) дегидрирования |
|
5. Сколько изомерных алкенов можно получить при |
|
|
а) 2 |
б) 1 |
|
в) 3 |
г) 4 |
|
6. Сколько изомерных алкенов отвечает эмпирической |
|
|
а) 4 |
б) 2 |
|
в) 3 |
г) 1 |
|
7. При взаимодействии бутена-1 с НСl образуется: |
|
|
а) преимущественно 1-хлорбутан |
б) смесь равных количеств |
|
в) преимущественно 2-хлорбутана |
г) бутана |
|
8. С раствором перманганата калия и бромной водой |
|
|
а) пропен и 1-хлорпропан |
б) этилен и пропен |
|
в) этан и этилен |
г) 1,2-дибромэтан и бутен-2 |
|
9. Укажите название вещества, которое преимущественно |
|
|
а) 2-бром-3-метилбутан |
б) 1-бром-3-метилбутан |
|
в) 2-метилбутан |
г) 1,2-дибром-3-метилбутан |
|
10. При полном гидрировании цис-2-бутена |
|
|
а) транс-2-бутен |
б) цис-бутан |
|
в) бутан |
г) транс-бутан |
Ответы:
|
1 |
в |
|
2 |
б |
|
3 |
б |
|
4 |
в |
|
5 |
в |
|
6 |
а |
|
7 |
в |
|
8 |
б |
|
9 |
а |
|
10 |
в |
Определите молекулярную формулу алкена, если известно, что относительная плотность паров этого вещества по воздуху равна 2,414
1. Вычислим относительную молекулярную массу алкена:
Mr(CnH2n) = Mr(воздуха) ⋅ Dв(CnH2n) = 29 ⋅ 2,414 = 70.
2. Относительная молекулярная масса вещества равна сумме атомных масс всех входящих в соединение атомов:
Mr(CnH2n) = n⋅Ar(C) + 2n⋅Ar(H) = 12n + 2n, или
70 = 12n + 2n, отсюда n = 5
3. Таким образом, молекулярная формула алкена С5Н10
Ответ: С5Н10
Алкен — непредельный углеводород, содержащий в своей структуре одну двойную связь.
Рассчитаем количество водорода, пошедшее на полное гидрирование алкена(двойная связь при этом разрывается и присоединяется водород по месту разрыва одной связи):
N(H2)=V(H2)/Vn,
Где Vn=22,4 л/моль
N(H2)=0,896/22,4=0,04 моль — количество водорода, пошедшее на гидрирование алкена.
Общий вид уравнения гидрирования алкенов:
CnH2n+H2=CnH(2n+2)
То есть алкен с водородом вступает в реакцию в отношении 1 к 1. Значит 2,8г алкена это 0,04 моль.
Отсюда вычислим молекулярную массу алкена:
М=m/N
M=2,8/0,04=70г/моль
Зная массу водорода 1г/моль и массу углерода 12г/моль и формулу алкена вычислим число атомов водорода и углерода:
12*n+1*2n=70
n=5
Такую молекулярную массу может иметь алкен с брутто формулой C5H10. Структурные формулы, например:
СН2=СН-СН2-СН2-СН3
СН3-СН=СН-СН2-СН3
Ответ:
Объяснение:
Плотность паров алкена по воздуху равна 2,41.Определите его молекулярную формулу.
1. Вычислим относительную молекулярную массу алкена:
29 ×2,41 = 70
Разделим молекулярную массу алкена на относительную молекулярную массу гомологической разности (-СН2) , равною 14
70 : 14 = 5.
В составе алкена 5 атомов углерода. Формула алкена С₅Н₁₀