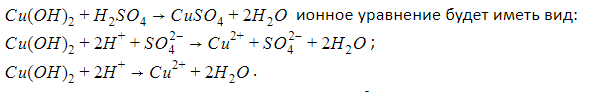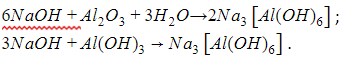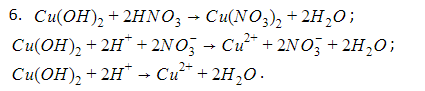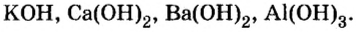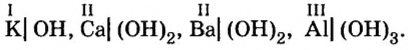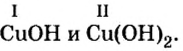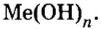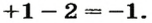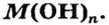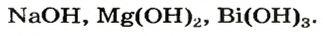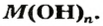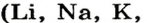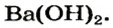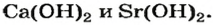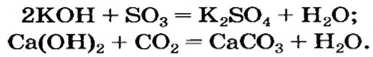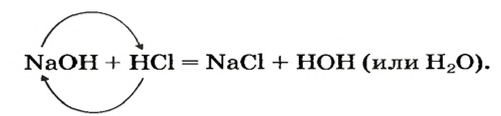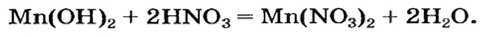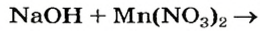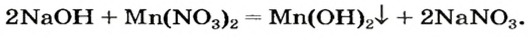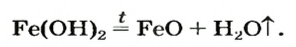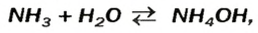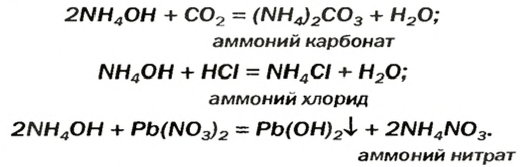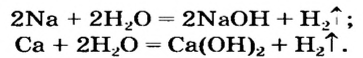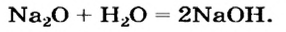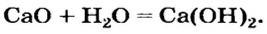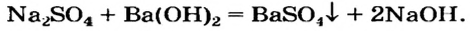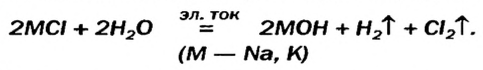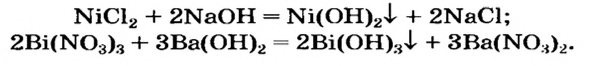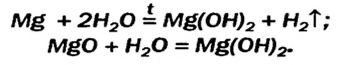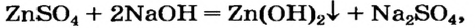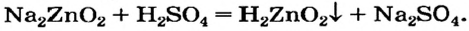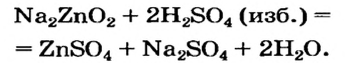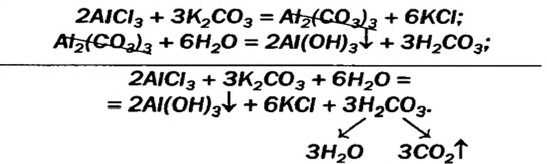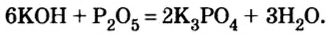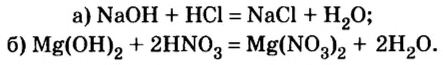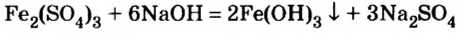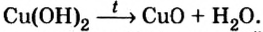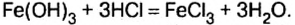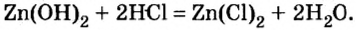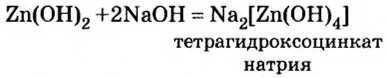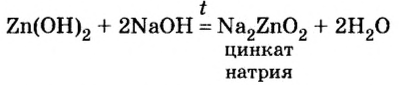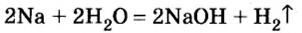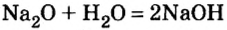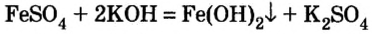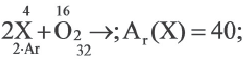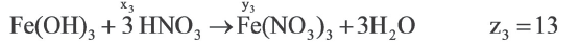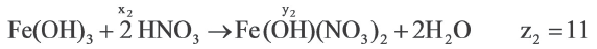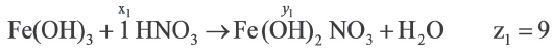Щелочи: определение, химические свойства, методы получения
Материал по химии
Оглавление
- Как связаны щелочи с основаниями?
- Чем отличаются щёлочи от остальных оснований?
- Как определить, является ли основание растворимым, то есть щелочью, если его нет в таблице растворимости?
- Физические свойства щелочей
- Химические свойства щелочей
- Получение щелочей
Как связаны щелочи с основаниями?
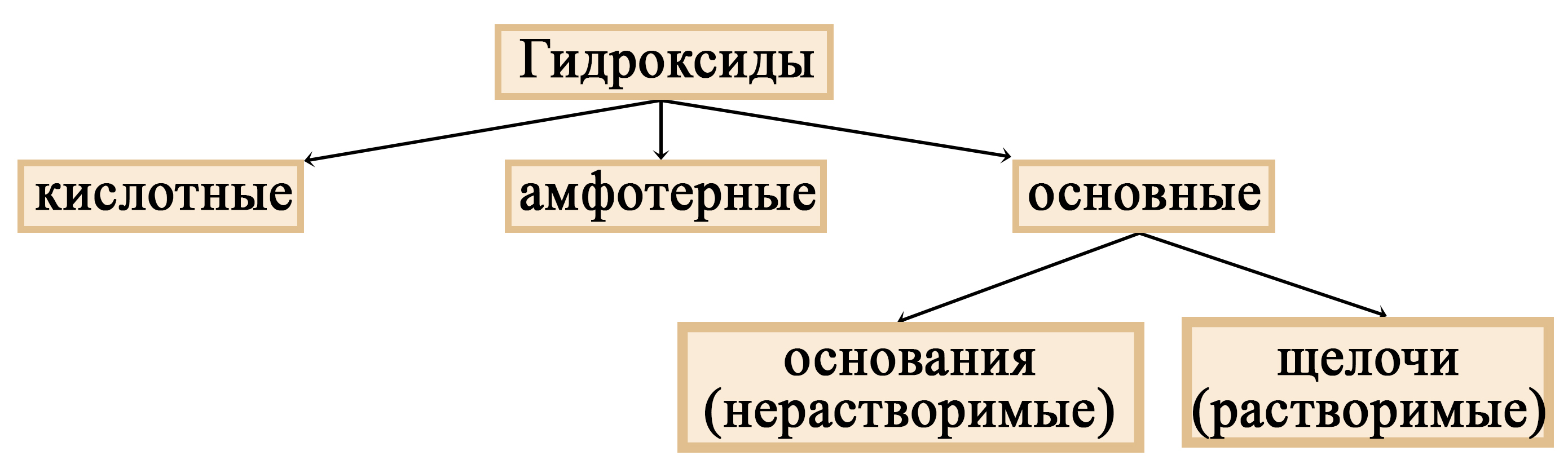
Щелочи – это небольшая группа неорганических веществ, относящихся к основным гидроксидам или основаниям. Для начала разберемся, какие вещества можно называть основаниями. Основания – это вещества, содержащие гидроксо-группу (‒OH), которая в неорганической химии (в случае с основаниями) пишется в конце молекулы, например: NaOH, Fe(OH)2, Ba(OH)2, но это определение не точное, ведь Fe(OH)3 и Zn(OH)2 имеют сходную формулу, однако, основаниями не являются. Точнее будет сказать, что основания – это гидроксиды, в которых металл находится в степени окисления «+1» или «+2» (кроме цинка и бериллия, образующих в степени окисления «+2» амфотерные оксиды и гидроксиды).
Таблица 1. – Основания и амфотерные гидроксиды
|
Это основания: |
Это НЕ основания: |
|
NaOH KOH Mg(OH)2 Ca(OH)2 Fe(OH)2 |
Al(OH)3 Fe(OH)3 Cr(OH)3 Zn(OH)2 Be(OH)2 |
|
Потому что содержат металл в степени окисления «+1» или «+2» |
Так как в этой группе есть гидроксиды, имеющие металл в степени окисления «+3», и два исключения — Zn(OH)2 и Be(OH)2. Все приведенные выше вещества являются амфотерными гидроксидами, а не основаниями |
Подробнее об отличиях понятий «гидроксиды» и «основания» можно прочитать в статье «Классификация гидроксидов и оснований»
Кроме отличий в степени окисления, основания и амфотерные гидроксиды отличаются так же по реакционной способности. Так, амфотерные гидроксиды могут реагировать как с кислотами, так и с основаниями, а основания могут реагировать с кислотами, но не могут реагировать с другими основаниями. Подробнее о химических свойствах амфотерных гидроксидов можно прочитать в статье «Амфотерные гидроксиды. Получение, химические свойства, образование средних и комплексных солей»
Чем отличаются щёлочи от остальных оснований?
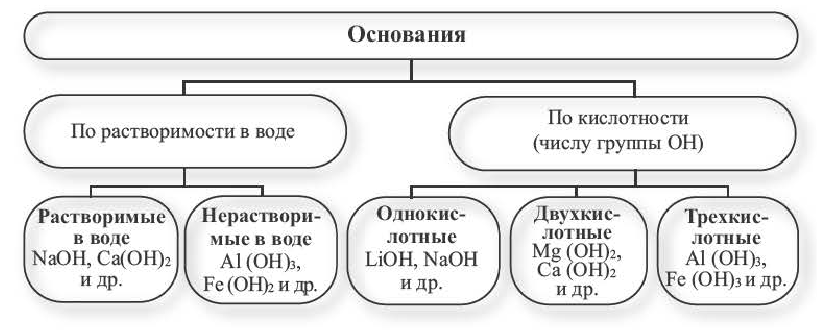
Основания можно разделить на две группы: растворимые и нерастворимые. Растворимые иначе называют щелочами. То есть щелочи – это растворимые основания (растворимые основные гидроксиды).
Таблица 2. – Основания и щёлочи
|
Щелочи (растворимые основания) |
Остальные основания (нерастворимые основания) |
|
NaOH KOH Ba(OH)2 |
Mg(OH)2 Fe(OH)2 Ni(OH)2 |
Место щелочей в классификации гидроксидов
Щелочи – растворимые основания
Как определить, является ли основание растворимым, то есть щелочью, если его нет в таблице растворимости?
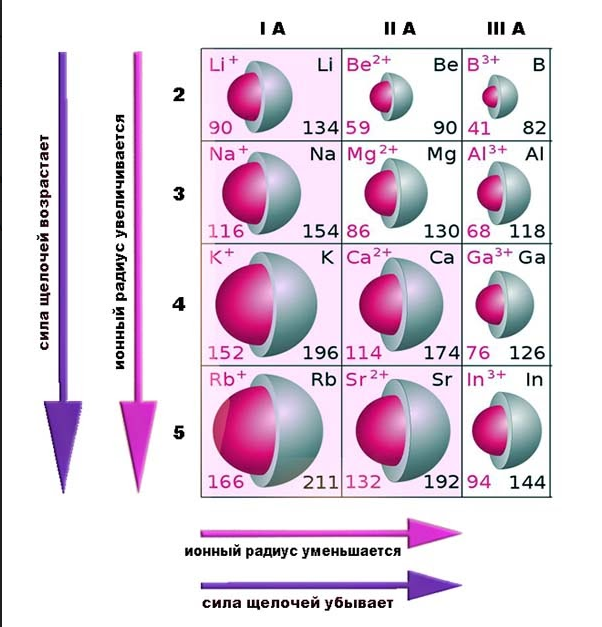
В состав щелочей входят металлы IА-группы Периодической Системы Д. И. Менделеева, а также кальций, стронций и барий.
Полный список щелочей:
NaOH – гидроксид натрия, едкий натр, гидроокись натрия, каустическая сода
KOH – гидроксид натрия, едкое кали, гидроокись калия
LiOH – гидроксид лития, гидроокись лития
CsOH – гидроксид цезия, гидроокись цезия
FrOH – гидроксид франция, гидроокись франция
RbOH – гидроксид рубидия, гидроокись рубидия
Ba(OH)2 – гидроксид бария, едкий барий, баритовая вода
Ca(OH)2 – гидроксид кальция, гашеная известь, известковое молоко, известковая вода.
Sr(OH)2 – гидроксид стронция
Остальные основания считаем нерастворимыми (кроме аммиака, образующего гидрат аммония, являющегося хоть и растворимым, но нестойким соединением). Гидроксид аммония, образующийся при пропускании аммиака через воду, можно представить в виде формулы NH4OH (лучше NH3·H2O – гидрат аммония) является растворимым (раствор называют нашатырным спиртом), однако щелочью это вещество не является.
Гидроксид лития и гидроксид кальция растворяются не так хорошо, как другие основания, но все равно считаются щелочами.
Задание в формате ЕГЭ с ответом:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ga(OH)3
- RbOH
- Cr(OH)2
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Комментарий к заданию: Галлий, в представленном гидроксиде, имеет степень окисления +3, поэтому он относится к группе амфотерных гидроксидов. Гидроксид рубидия – щелочь, так как рубидий – элемент IА-группы. Гидроксид хрома – нерастворимое основание, так как хром в степени окисления +2 не является амфотерным, и не относится к щелочным или щелочноземельным металлам, поэтому не может образовать щелочь.
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Sr(OH)2
- Zn(OH)2
- Fe(OH)2
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Комментарий к заданию: Стронций является щелочноземельным металлом (металлы IIА-группы, кроме магния и бериллия, образуют растворимые гидроксиды), поэтому образует щелочь. Гидроксид цинка вместе с гидроксидом бериллия входят в группу исключений и, несмотря на вторую валентность, образуют амфотерные гидроксиды. Гидроксид железа нерастворим и не входит в группу амфотерных веществ, он является нерастворимым основанием.
Щёлочи, являясь сильными основаниями, диссоциируют в воде очень быстро, тогда как нерастворимые основания диссоциируют медленно, ступенчато:
|
Диссоциация щелочей |
Диссоциация слабых оснований |
|
Ca(OH)2 = Ca2+ + 2OH‒ |
Fe(OH)2 = FeOH+ + OH‒ (I ступень) FeOH+ = Fe2+ + OH‒(II ступень) |
|
Диссоциация настолько быстрая, что ступенчатостью процесса можно пренебречь |
Диссоциация очень медленная, быстрее идет по первой ступени, по второй ступени практически не идёт |
Физические свойства щелочей
Гидроксиды щелочных металлов (металлов IА-группы) – твердые бесцветные кристаллические вещества. Как уже было описано выше, большинство из них очень хорошо растворимы в воде. Гидроксиды щелочноземельных металлов хуже растворяются в воде.
Химические свойства щелочей
Основные свойства гидроксидов в Периодической системе возрастают справа налево и сверху вниз. Поэтому все щелочи, образованные металлами IА-группы сильнее щелочей, образованных металлами IIА-группы.
Щелочи окрашивают фенолфталеин в малиновый цвет.
Твёрдые щелочи и их концентрированные растворы разъедают живые ткани, поэтому работать с ними нужно в перчатках, а при растирании твёрдой щелочи в ступке необходимо надевать очки.
- Щелочи реагируют с кислотными оксидами, образуя либо соль и воду, либо кислую соль:
Щелочь + кислотный оксид = соль + вода
Щелочь + кислотный оксид = кислая соль
Рассмотрим эти реакции на примере образования карбонатов и гидрокарбонатов.
Для щелочей, содержащих одновалентный катион (катион в степени окисления «+1») справедлива общая схема реакции:
2MeOH + CO2 = Me2CO3 + H2O
Или
MeOH + CO2 = MeHCO3
Например:
2NaOH + CO2 = Na2CO3 + H2O
NaOH + CO2 = NaHCO3
2KOH + CO2 = K2CO3 + H2O
KOH + CO2 = KHCO3
Для щелочей, содержащих двухвалентный металл (катион в степени окисления «+2») справедлива общая схема реакции:
Me(OH)2 + CO2 = MeCO3 + H2O
Или
Me(OH)2 + 2CO2 = Me(HCO3)2
Например:
Ca(OH)2 + CO2 = CaCO3 + H2O
Ca(OH)2 + 2CO2 = Ca(HCO3)2
Ba(OH)2 + CO2 = BaCO3 + H2O
Ba(OH)2 + 2CO2 = Ba(HCO3)2
Образование кислых и средних солей
Щелочи с кислотными оксидами
Щелочи при плавлении разрушают стекло и фарфор, основным компонентом которых является кислотный оксид SiO2:
2NaOH(тв) + SiO2(тв) = Na2SiO3(тв) + H2O(г)
Некоторые оксиды диспропорционируют в щелочах (участвуют в реакции самоокисления-самовосстановления). К таким оксидам относят оксид азота IV, который в щелочах превращается одновременно и в нитрит-ион (NO2‒), и нитрат-ион (NO3‒):
2KOH + 2NO2 = KNO2 + KNO3 + H2O
2Ca(OH)2 + 4NO2 = Ca(NO2)2 + Ca(NO3)2 + 2H2O
Для того, чтобы получить только нитрат-ион необходимо присутствие кислорода:
4KOH + 4NO2 + O2 = 4KNO3 + 2H2O
2Ca(OH)2 + 4NO2 + O2 = 2Ca(NO3)2 + 2H2O
О других свойствах кислотных оксидов можно прочитать в статье «Свойства кислотных оксидов»
- Щелочи реагируют с кислотами. Притом, если кислота одноосновная, то образуется только средняя соль, если кислота многоосновная, то может образоваться как средняя, так и кислая соль.
Узнать, как определить тип кислоты можно в статье «Классификация кислот»
А) щелочь + одноосновная кислота = соль + вода
NaOH + HClO3 = NaClO3 + H2O
LiOH + HNO3 = LiNO3 + H2O
KOH + HI = KI + H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Ba(OH)2 + 2HClO4 = Ba(ClO4)2 + 2H2O
Sr(OH)2 + HPO3 = Sr(PO3)2 + H2O
Б) щелочь + двухосновная кислота = соль + вода
Щелочь + двухосновная кислота = кислая соль + вода
2NaOH + H2SO4 = Na2SO4 + 2H2O
NaOH + H2SO4 = NaHSO4 + H2O
Ba(OH)2 + H2S = BaS + 2H2O
Ba(OH)2 + 2H2S = Ba(HS)2 + 2H2O
Для получения кислой соли необходим недостаток щелочи (избыток кислоты).
Задание по образцу ФИПИ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Sr(OH)2 + SO2 =
- Sr(OH)2 +2SO2 =
- Sr(OH)2 + H2SO4 =
- Sr(OH)2 + 2H2SO4 =
- SrSO4 + 2H2O
- SrSO3 + H2O
- SrSO4 + H2O
- Sr(HSO4)2 + 2H2O
- Sr(HSO3)2 + H2O
- Sr(HSO3)2
- В отличие от нерастворимых оснований, щелочи реагируют с растворимыми солями. Условия типичны для обменных реакций (в продуктах должен появиться газ или осадок):
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
LiOH + NH4Cl = LiCl + NH3↑ + H2O
2KOH + Fe(NO3)2 = 2KNO3 + Fe(OH)2↓
Ca(OH)2 + 2NaF = CaF2↓ + 2NaOH
Ba(OH)2 + K2SO4 = BaSO4↓ + 2KOH
Sr(OH)2 + Na2SiO3 = SrSiO3↓ + 2NaOH
Попробуйте решить задание ЕГЭ:
Из предложенного перечня веществ выберете три вещества, с которыми гидроксид натрия (р-р) не реагирует:
- LiCl
- NH4Br
- CrSO4
- PbSO4
- KNO3
- CuSO4
Комментарий к заданию: помните, что исходная соль должна быть растворимой, а одно из полученных веществ – газ или осадок.
- Щелочи реагируют с кислыми солями с образованием средних солей:
NaHSO3 + NaOH = Na2SO3 + H2O
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
- Твёрдые щелочи реагируют с амфотерными оксидами и гидроксидами при сплавлении, при этом образуется средняя соль, в катион которой входит щелочной или щелочноземельный металл, а в анион – амфотерный металл:
2NaOH + Al2O3 = 2NaAlO2 + H2O
2NaOH + ZnO = Na2ZnO2 + H2O
Ca(OH)2 + Al2O3 = Ca(AlO2)2 + H2O
Ca(OH)2 + ZnO = CaZnO2 + H2O
Из предложенного перечня веществ выберете три вещества, с которыми реагирует гидроксид калия:
- P2O5
- Cr2O3
- NiO
- FeO
- CaO
- ZnO
Комментарий к заданию: Не забывайте, что щелочи реагируют не только с амфотерными, но и с кислотными оксидами.
О том, как амфотерные оксиды реагируют с щелочами и другими веществами, а также о том, как можно прочитать в статье «Амфотерные оксиды»
NaOH + Al(OH)3 = NaAlO2 + 2H2O
NaOH + Zn(OH)2 = Na2ZnO2 + H2O
Ca(OH)2 + 2Al(OH)3 = Ca(AlO2)2 + 4H2O
Ca(OH)2 + Zn(OH)2 = CaZnO2 + 2H2O
Подробнее о свойствах амфотерных гидроксидов можно прочитать в этой статье
- Концентрированные растворы щелочей растворяют амфотерные оксиды и гидроксиды с образованием комплексных солей:
2KOH + Fe2O3 + 3H2O = 2K[Fe(OH)4]
2KOH + BeO + H2O = K2[Be(OH)4]
Ba(OH)2 + Fe2O3 + 3H2O = Ba[Fe(OH)4]2
Ba(OH)2 + BeO + H2O = Ba[Be(OH)4]
KOH + Fe(OH)3 = K[Fe(OH)4]
2KOH + Be(OH)2 = K2[Be(OH)4]
Ba(OH)2 + 2Fe(OH)3 = Ba[Fe(OH)4]2
Ba(OH)2 + Be(OH)2 = Ba[Be(OH)4]
- Концентрированные щелочи вступают в реакции с некоторыми металлами (Al, Be, Zn) с образованием комплексной соли и выделением водорода:
2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] + 3H2↑
2NaOH + Be + 2H2O = Na2[Be(OH)4] + H2↑
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2↑
Ba(OH)2 + 2Al + 6H2O = Ba[Al(OH)4]2 + 3H2↑
Ba(OH)2 + Zn + 2H2O = Ba[Zn(OH)4] + H2↑
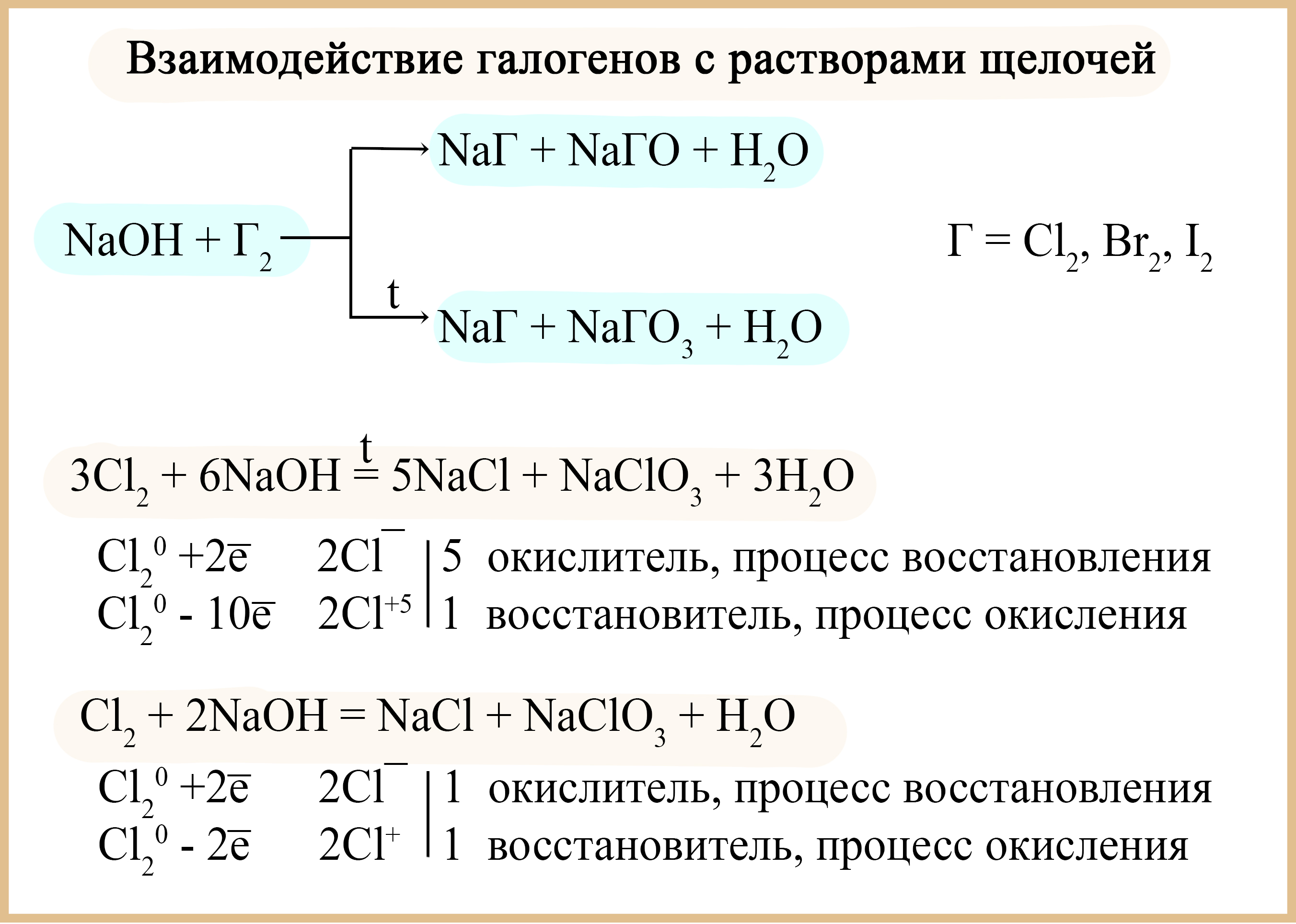
- Хлор, бром, йод диспропорционируют в щелочах, продукты реакции зависят от температуры, при которой происходит реакция:
Cl2 + 2NaOH(холодный) = NaCl + NaClO +H2O
3Cl2 + 6NaOH(горячий) = 5NaCl + NaClO3 + 3H2O
Реакция хлора с гидроксидом натрия
Диспропорционирование галогенов в щелочах
- Фосфор, сера также самоокисляются-самовосстанавливаются в щелочах:
P4 + 3NaOH + 3H2O = 3NaH2PO2 + PH3
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
- Кремний реагирует с щелочами в качестве восстановителя:
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
Получение щелочей
- Щелочи можно получить из гидридов, нитридов, фосфидов, карбидов:
LiH + H2O = LiOH + H2↑
CaH2 + 2H2O = Ca(OH)2 + 2H2↑
Na3N + 3H2O = 3NaOH + NH3↑
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3↑
K3P + 3H2O = 3KOH + PH3↑
Ba3P2 + 6H2O = 3Ba(OH)2 + 2PH3↑
Na4C + 4H2O = 4NaOH + CH4↑
CaC2 + 2H2O = Ca(OH)2 + C2H2↑
- При растворении оксида щелочного или щелочноземельного металла в воде образуется раствор щелочи:
Na2O + H2O = 2NaOH
BaO + H2O = Ba(OH)2
Реакции идут с выделением большого количества теплоты, то есть являются экзотермическими.
- Щелочи можно получить растворением пероксидов в воде (характерно для получения гидроксида натрия, гидроксида калия и гидроксида бария):
Na2O2 + 2H2O = H2O2 + 2NaOH
BaO2 + 2H2O = H2O2 + Ba(OH)2
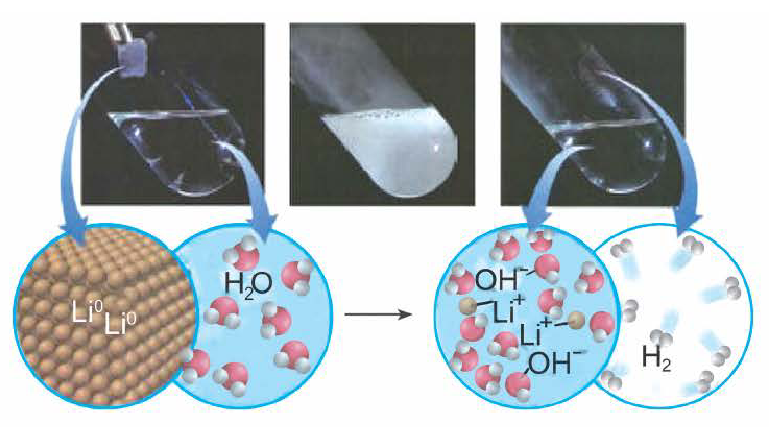
- Раствор щелочи получают при растворении щелочного или щелочноземельного металла в воде:
2K + 2H2O = 2KOH + H2↑
Sr + 2H2O = Sr(OH)2 + H2↑
- Растворы щелочей можно получить обменными реакциями:
Li2SO4 + Ba(OH)2 = 2LiOH + BaSO4↓
K2SO4 + Sr(OH)2 = 2KOH + SrSO4↓
- Раствор щелочи можно получить электролизом раствора соли, содержащей катион щелочного или щелочноземельного металла и бескислородный анион, например раствор гидроксида калия получают электролизом раствора хлорида калия:
KCl + H2O = KOH + H20↑ + Cl20↑
Катод: 2H2O + 2ē = H20↑ + 2OH‒
Анод: 2Cl‒ ‒2ē = Cl20
Электролизом расплава соли, содержащей щелочной металл, щелочь получить нельзя. Этим способом получают сам щелочной металл.
Содержание
- 1 Определение. Структура и формула основания
- 2 Номенклатура
- 3 Классификация
- 3.1 Щелочи
- 4 Свойства
- 4.1 Химические свойства
- 5 Получение
- 6 Применение
- 6.1 Задания
- 6.2 Ответы
Основания в химии – совокупность соединений с характерной способностью к взаимодействию с кислотами, в результате которого происходит образование солей. Основания связаны с основными оксидами.
Определение. Структура и формула основания
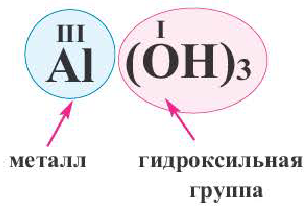
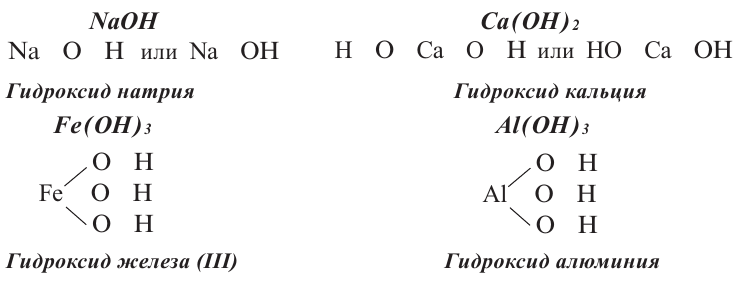
Основания (основные гидроксиды) – соединения, образуемые связью между положительно заряженным ионом металла и высокореакционной гидроксильной группой – анионом OH-. В зависимости от валентности металла его ион может присоединять одну или несколько гидроксогрупп.
В составе основания катион металла и протон H+, входящий в гидроксогруппу, взаимно отталкиваются. Их удерживает притяжение к отрицательному иону кислорода O2-, причем протон расположен ближе и притягивается сильнее. Связь с металлом менее прочна, и ее величина определяется радиусом металлического иона.
Общий вид формулы основного гидроксида — MeOHn. Для определения величины n – количества гидроксогрупп, присоединяющихся к металлу, необходимо знать его степень окисления :
| натрий Na+ | n=1 | NaOH |
| железо(II) Fe2+ | n=2 | FeOH2 |
| железо(III) Fe3+ | n=3 | FeOH3 |
В качестве основания может рассматриваться гидрат аммиака () в водном растворе, в этом случае формула данного соединения записывается как NH4OH.
Номенклатура
Наименования оснований строятся по правилу: «гидроксид + название металла». Если степень окисления металла непостоянна, в названии указывается его валентность: гидроксид железа(III).
Некоторые основания имеют, помимо систематических, тривиальные (традиционные и технические) названия:
|
Основание |
Тривиальное название |
| гидроксид натрия NaOH | едкий натр; каустик (техн.) |
| гидроксид калия KOH | едкое кали; калиевый щелок |
| гидрат аммиака NH4OH (в растворе – гидроксид аммония) | аммиачная вода |
| гидроксид кальция Ca (OH2) | гашеная известь; пушонка |
| гидроксид бария Ba (OH2) (в растворе) | баритовая вода |
Классификация
Основания подразделяются по следующим признакам:
Растворимость в воде:
- растворимые – гидроксиды щелочных и щелочноземельных металлов, тяжелого металла таллия(I) TlOH, а также гидроксид аммония;
- нерастворимые.
Кислотность – количество n соединенных с металлом гидроксид-ионов OH-: одно-, двух-, трехкислотные.
Сила – способность к диссоциации, то есть отдаче гидроксид-ионов:
- сильные (все растворимые, за исключением гидроксида аммония, и малорастворимые гидроксиды щелочноземельных металлов кальция Ca(OH2) и стронция Sr(OH2);
- слабые (нерастворимые в воде основания и гидроксид аммония NH4OH).
Щелочи
К щелочам относят сильные основания, растворимые в воде. В отношении гидроксидов кальция и стронция понятие «щелочь» применяется к растворенной части:
Формула щелочи имеет вид ROH либо ROH2 в зависимости от степени окисления образующего ее металла R. Трехосновных щелочей не существует. В таблице представлены щелочи, образованные металлами разных групп периодической таблицы:
|
Металлы |
Гидроксиды |
Щелочные (I A):
|
«Едкие щелочи»:
LiOH NaOH KOH RbOH CsOH |
Щелочноземельные (II A):
|
Ca(OH2)
Sr(OH2) Ba(OH2) Ra(OH2) |
III A:
|
TlOH |
Чем больше радиус металлического катиона и чем меньше его заряд (степень окисления), тем слабее связь с гидроксогруппой OH- и, следовательно, тем сильнее основание. Наиболее сильные щелочи в химии – это гидроксиды цезия и радия: у этих металлов самые крупные ионы. Соответственно слабейшая из щелочей – гидроксид лития.
Свойства
В стандартных условиях основания – твердые вещества с кристаллическим строением, различных оттенков (чаще белые или бесцветные), без запаха. Едкие щелочи в твердом состоянии чрезвычайно гигроскопичны. Расплавы и растворы щелочей являются электролитами.
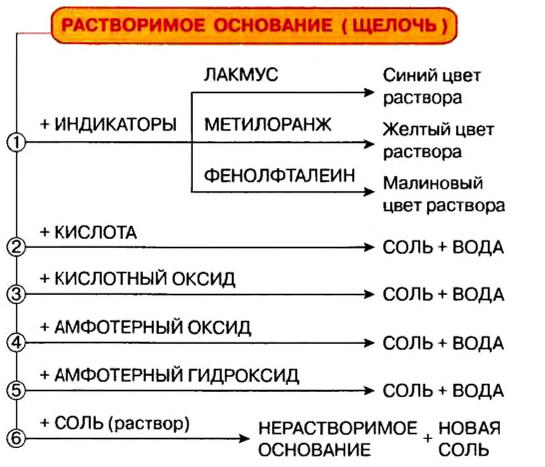
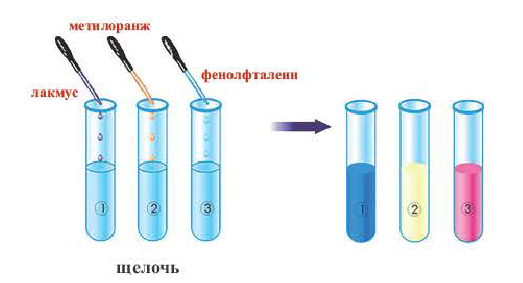
Водные растворы щелочей – мылкие жидкости, вызывающие изменение цвета индикаторов:
- лакмус: фиолетовый → синий;
- фенолфталеин: бесцветный → малиновый;
- метилоранж: оранжевый → желтый;
- универсальный: оранжевый → синий.
Концентрированные щелочные растворы опасны в обращении. При работе с ними необходимо использовать средства защиты и соблюдать технику безопасности. Едкие щелочи растворяются не только в воде, но также в метаноле и этаноле.
Химические свойства
1. В растворах и расплавах сильные основания диссоциируют:
Гидроксид аммония – неустойчивое соединение и самопроизвольно разлагается на аммиак и воду:
2. Взаимодействие с кислотами
Реакции нейтрализации между щелочью и кислотой, продуктами которых являются соль и вода:
Ионное уравнение: ; сокращенное
.
Слабое основание не диссоциирует, поэтому для реакции
- Реакция протекает не до конца при избытке одного из реагентов:
– образуется основная соль сульфат гидроксомеди(II);
– образуется кислая соль дигидрофосфат натрия.
Если оба реагента слабые, реакция не идет.
3. Взаимодействие с оксидами и гидроксидами
- Между щелочью и кислотным оксидом с образованием соли и воды:
- Между щелочным расплавом и амфотерным оксидом либо гидроксидом:
- Между раствором щелочи и амфотерным оксидом (гидроксидом):
В реакциях этого типа образуется комплексная соль (здесь – гексагидроксоалюминат натрия).
Нерастворимые основания принадлежат к амфотерным гидроксидам: по отношению к сильным основаниям они обладают кислотными свойствами.
4. Между щелочью и растворимой солью протекает реакция обмена, если хотя бы один из продуктов выпадает в осадок:
Ионное уравнение: ; сокращенное –
.
5. Участие в окислительно-восстановительных реакциях с металлами, не образующими основных оксидов (Be, Al, Zn, Sn), и с некоторыми неметаллами:
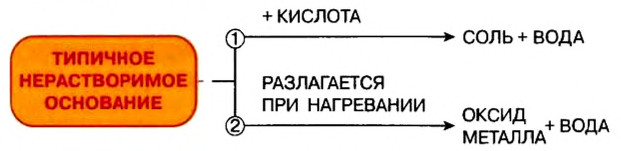
6. Разложение на оксид и воду при нагревании нерастворимых и малорастворимых оснований:
.
Легкорастворимые щелочи устойчивы к нагреванию, за исключением гидроксида лития.
Получение
Это интересно:
Масса молекул. Количество вещества и моль
О химических элементах и атомах
Применение
Физико-химические свойства оснований сделали их незаменимыми веществами во всех отраслях, использующих химические технологии:
- в добыче полезных ископаемых и металлургии;
- в производстве потребительских товаров, косметической, пищевой и фармацевтической продукции;
- в производстве красителей, бытовой химии и удобрений;
- в топливной и химической промышленности;
- в строительстве и многих других областях.
Наиболее широко применяются щелочи, но и нерастворимые основания используются в производстве полимеров, в очистных сооружениях, в медицине, в электротехнике.
Задания
1. Какое соединение в ряду KOH, Ra(OH2), BeO, P2O5, HBrO3, Al(OH3) является:
-
- амфотерным оксидом;
- едкой щелочью;
- кислотным оксидом;
- нерастворимым основанием;
- гидроксидом щелочноземельного металла?
2. Какое основание в каждой из пар является более сильным?
-
- Ca(OH)2 или Mg(OH)2;
- Ba(OH)2 или Ca(OH)2;
- Ra(OH)2 или CsOH;
- Sr(OH0)2 или Al(OH)3;
- KOH или LiOH.
3. Какие соединения образуются в результате реакции Zn(OH)2+H2SO4? Напишите ее молекулярное и ионное уравнения.
4. Какие соединения являются продуктом реакции между гидроксидом натрия и оксидом азота(V)? Напишите уравнения в молекулярной и ионной форме.
5. Какое основание можно получить, используя реакцию между гидроксидом калия и сульфатом магния? Запишите ее уравнения.
6. Составьте молекулярные и ионные уравнения реакций, позволяющих осуществить превращения .
Ответы
Содержание:
Основания, как и оксиды, кислоты и соли, относятся к сложным неорганическим веществам. Выясним, из каких частей состоит формула любого основания, воспользовавшись таким рядом формул:
Разделим формулы черточкой на две части, отделив символ металлического элемента от остальных символов, и напишем над металлом его валентность:
Общим для всех формул является наличие группы атомов 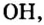
Как вы уже знаете, понятие валентности распространяется на группы атомов, в частности на кислотные остатки. Имеет свою валентность и гидроксильная группа 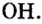
Теперь можем сформулировать определение оснований:
Основания — это сложные вещества, образованные металлическим элементом и гидроксильными группами.
Запишем формулу оснований в общем виде:
Следует отметить, что основания, как и соли,— вещества не молекулярного, а ионного строения, поэтому их формулы отображают соотношения ионов металла 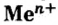
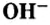
Номенклатура оснований
По современной номенклатуре название оснований состоит из двух слов: слова гидроксид и названия металлического элемента, например: 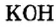
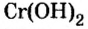
У некоторых оснований сохранились также исторические названия: 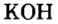
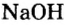
Составление формул оснований и определение валентности металла в формуле основания. Рассмотрим на примерах, как составлять формулы оснований и определять валентность металла по формуле основания.
Пример:
Составить формулу гидроксида магния.
Решение
Исходя из определения оснований, первым записываем символ металла, а после него — гидроксильную группу 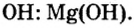
Ответ: формула основания —
Пример 2. Определить валентность меди в формулах оснований
Решение
Известно, что в формуле основания валентность металла совпадает с количеством гидроксильных групп. Первая формула содержит одну гидроксильную группу, вторая — две. Поэтому в первой формуле медь одновалентна, а во второй — двухвалентна.
Ответ:
Физические свойства и классификация оснований
Основания — твердые вещества, преимущественно белого цвета, хотя встречаются и других цветов. Например, гидроксид меди
По способности растворяться в воде основания, как и соли, бывают растворимые, малорастворимые и нерастворимые. Преобладают нерастворимые. Среди хорошо растворимых — гидроксид натрия, гидроксид калия. Их растворы мылкие на ощупь.
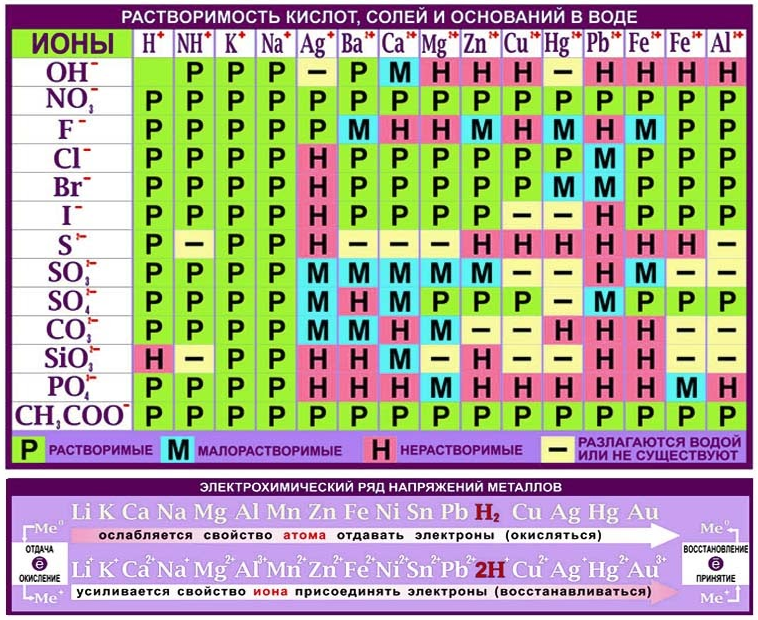
Растворимые в воде основания получили название щелочи. По таблице растворимости солей, оснований и кислот можно узнать, к какой группе по способности растворяться в воде принадлежит то или иное основание.
Итак, по физической характеристике — способности растворяться в воде — основания разделяют на растворимые, или щелочи, и нерастворимые.
Существует еще одна классификация оснований — по химическим свойствам. Согласно ей их разделяют на типичные основания и амфотерные гидроксиды. Но об этом речь пойдет позже.
Основания, хорошо растворимые в воде,— тугоплавкие вещества. Основания, нерастворимые в воде, при нагревании разлагаются с выделением воды и образованием оксида.
Итоги:
- Основания — сложные вещества немолекулярного строения, химическая формула которых состоит из одного атома металла и одной или нескольких гидроксильных групп.
- Число одновалентных гидроксильных групп в формуле основания равно валентности металла, поэтому в общем виде формула оснований имеет вид
- Современное название основания состоит из слова гидроксид с добавлением к нему названия металла. Если металл проявляет переменную валентность, то ее указывают после названия металла в скобках.
- При обычных условиях основания находятся в твердом состоянии, часть из них хорошо растворяется в воде. Растворенные в воде основания называются щелочами.
Что такое основания
Известь — соединение, известное человеку давно. Смесь извести с водой нередко используют и в настоящее время в строительстве. Такой смесью белят стволы и ветки деревьев, защищая их от вредителей, а зимой — от солнечных ожогов. Известь (точнее — гашеная известь) 
Каждое основание образовано тремя элементами. Из них два элемента «обязательные» — Оксиген и Гидроген, а третьим является металлический элемент.
Основание — соединение, которое состоит из катионов металлического элемента 
Название иона 

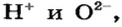
Формулы оснований
Выведем общую химическую формулу соединений этого класса. Вы знаете, что любое вещество электронейтрально. Поэтому в основании на каждый ион металлического элемента с зарядом +n должно приходиться n ионов 
Примеры химических формул оснований:
Основания — ионные соединения. Поэтому для них не составляют графические формулы.
Названия оснований
Химические названия оснований состоят из двух слов. Первым словом является название элемента, а вторым — «гидроксид». Например, соединение с формулой 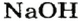
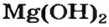
Если элемент имеет переменную валентность, то в названии основания указывают ее значение после названия элемента (римской цифрой в скобках): 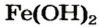
Это интересно. Оснований 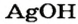
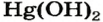
Среди соединений с общей формулой 
Основание 
Заряд иона металлического элемента в основании и оксиде один и тот же.
Оксиды, которые отвечают основаниям, называют основными.
В отличие от оксидов, оснований в природе нет.
Выводы:
Основания — соединения, которые содержат катионы металлических элементов 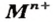

Химическое название основания состоит из названия металлического элемента и слова «гидроксид».
Каждому основанию соответствует оксид; его называют основным оксидом. Заряд иона металлического элемента в этих соединениях один и тот же.
Свойства и применение оснований
Физические свойства оснований:
Вам известно, что каждое основание состоит из положительно заряженных ионов металлического элемента и отрицательно заряженных гидроксид-ионов 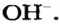
Большинство оснований не растворяются в воде (рис. 20). Малорастворимыми являются гидроксиды 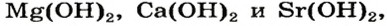
> > >
Водорастворимые основания называют щелочами*.
* — К щелочам часто относят соединения
Сведения о растворимости оснований в воде можно найти в таблице, размещенной на форзаце 2 учебника. Ее называют таблицей растворимости. Приводим соответствующий фрагмент этой таблицы:
Растворимость некоторых оснований в воде при температуре 20—25 °С
Буквой «р» обозначены растворимые основания (щелочи), «м» —малорастворимые, «н>> — нерастворимые. Прочерк «— » означает, что такого основания не существует.
Щелочи и их растворы мылки на ощупь, разъедают многие материалы, вызывают серьезные ожоги кожи, слизистых оболочек, сильно поражают глаза (рис. 21). Поэтому натрий гидроксид в прошлом получил название «едкий натр», а калий гидроксид — «едкое кали ».
Работая со щелочами и их растворами, будьте особенно осторожны. Если раствор щелочи попал на руку, немедленно смойте его большим количеством проточной воды и обратитесь за помощью к учителю или лаборанту. Вы получите у них разбавленный раствор определенного вещества (например, уксусной кислоты), которым нужно обработать кожу для удаления остатков щелочи. После этого руку тщательно промойте водой.
Химические свойства оснований:
Возможность протекания многих реакций с участием оснований зависит от растворимости этих соединений в воде. Щелочи в химических превращениях значительно более активны, чем нерастворимые основания, которые, например, с солями и некоторыми кислотами не реагируют.
Действие на индикаторы:
Растворы щелочей способны изменять окраску особых веществ — индикаторов*. Эти вещества были обнаружены в некоторых плодах и цветах. В настоящее время используют индикаторы, которые производят на химических заводах. Они более эффективны, чем природные, и лучше сохраняются.
К важнейшим индикаторам относятся лакмус, фенолфталеин, метиловый оранжевый (сокращенное название — метилоранж), а также универсальный индикатор. Последний является смесью нескольких веществ. Эта смесь, в отличие от отдельных веществ-индикаторов, изменяет цвет не только в присутствии щелочи, но и в зависимости от ее количества в растворе.
В химических лабораториях применяют водные растворы метилоранжа и лакмуса, водно-спиртовый раствор фенолфталеина. Очень удобна в использовании так называемая индикаторная бумага. Это — специальная бумага, пропитанная раствором индикатора, а затем высушенная и нарезанная маленькими полосками (рис. 22). Существует также индикаторная бумага, пропитанная раствором лакмуса или фенолфталеина.
Изменение окраски индикатора (рис. 23) является следствием его реакции со щелочью.
* — Термин происходит от латинского слова indico — указываю, определяю.
Уравнения таких реакций не приводим, поскольку формулы индикаторов и продуктов их химических превращений довольно сложные.
Нерастворимые основания на индикаторы не действуют.
Реакции с кислотными оксидами
Растворимые и нерастворимые основания взаимодействуют с соединениями противоположного характера, т. е. имеющими кислотные свойства. Среди этих соединений — кислотные оксиды. Соответствующие реакции были рассмотрены в предыдущем параграфе. Приводим дополнительные примеры:
Реакции с кислотами
При взаимодействии основания с кислотой вещества обмениваются своими составными частями:
Это — реакция обмена.
Выяснить, осталась ли щелочь после добавления определенной порции кислоты, можно, добавив к жидкости 1 — 2 капли раствора фенолфталеина. Если малиновый цвет не появился, то щелочь полностью прореагировала с кислотой.
Пример реакции нерастворимого основания с кислотой:
Реакцию между основанием и кислотой называют реакцией нейтрализации.
Выяснить, осталась ли щелочь после добавления определенной порции кислоты, можно, добавив к жидкости 1 — 2 капли раствора фенолфталеина. Если малиновый цвет не появился, то щелочь полностью прореагировала с кислотой.
Пример реакции нерастворимого основания с кислотой:
Мп(ОН)2 + 2HN03 = Mn(N03)2 + 2Н20.
Реакцию между основанием и кислотой называют реакцией нейтрализации.
Реакции щелочей с солями
Это — реакции обмена. Они происходят в растворе, причем исходная соль должна быть растворимой, а новое основание или новая соль — нерастворимыми.
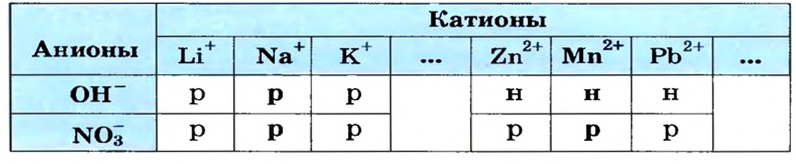
Выясним возможность реакции между натрий гидроксидом и манган(II) нитратом:
Воспользуемся таблицей растворимости (приводим ее фрагмент):
Как видим, соль 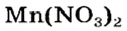
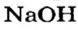
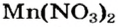
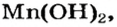
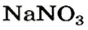
Термическое разложение
Почти все основания (кроме гидроксидов Натрия и Калия) при нагревании разлагаются на соответствующий оксид и воду (водяной пар):
Взрослым известна жидкость под названием «нашатырный спирт». Это — водный раствор газа аммиака 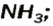
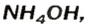
в которую вступает небольшая часть растворенного аммиака, и одновременно разлагается на исходные вещества. На это указывает знак 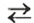
Аммоний гидроксид подобно щелочам (NaOH, КОН и др.) изменяет окраску индикаторов, взаимодействует с кислотными оксидами, кислотами, солями:
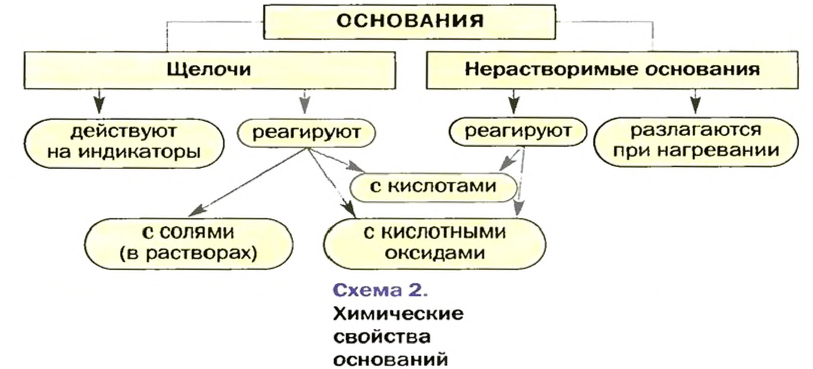
Изложенный материал обобщен в схеме 2.
Применение оснований
Широкое применение среди оснований получили щелочи, прежде всего гидроксиды Кальция и Натрия.
Вам известно, что вещество, называемое гашеной известью, является кальций гидроксидом 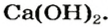
Натрий гидроксид используют при производстве мыла (осуществляют реакции щелочи с жирами), лекарств, в кожевенной промышленности, для очистки нефти и т. д.
Выводы:
Основания — твердые вещества ионного строения. Большинство оснований не растворяется в воде. Водорастворимые основания называют щелочами. Щелочи изменяют окраску особых веществ — индикаторов.
Основания взаимодействуют с кислотными оксидами и кислотами с образованием солей и воды. Щелочи реагируют и с солями; продукты каждой реакции — другие основание и соль. Нерастворимые основания разлагаются при нагревании на соответствующие оксиды и воду.
Реакцию между основанием и кислотой называют реакцией нейтрализации. На практике используют преимущественно гидроксиды Кальция и Натрия.
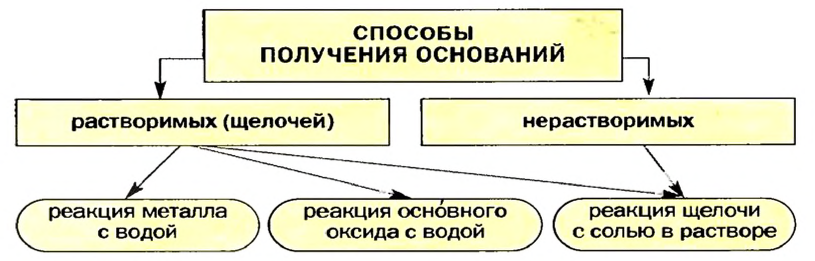
Способы получения оснований и амфотерных гидроксидов
Получение щелочей: один из способов получения щелочей основан на реакции металла с водой (рис. 40). Кроме щелочи, образуется водород:
Второй способ получения щелочей — взаимодействие основного оксида с водой:
Таким способом получают гашеную известь на заводах и непосредственно перед использованием этого вещества для строительных работ, побелки стволов деревьев:
Щелочь можно получить и с помощью реакции обмена между растворимой солью и другой щелочью (в растворе). Исходные соединения подбирают так, чтобы образовалась нерастворимая соль:
Гидроксиды Натрия и Калия производят в промышленности действием постоянного электрического тока на водные растворы хлоридов:
Этот процесс называют электролизом.
Получение нерастворимых оснований
Нерастворимое основание можно получить только с помощью реакции обмена между солью и щелочью в растворе. Поскольку основание будет выпадать в осадок, то образующаяся соль должна быть растворимой в воде (два нерастворимых соединения разделить невозможно):
Малорастворимый магний гидроксид может быть не только продуктом реакции обмена. Это соединение, как и щелочи, образуется при взаимодействии металла или оксида с водой. Правда, эти реакции происходят медленно, а первая — только при нагревании:
Изложенное обобщает схема 7.
Схема 7. Получение оснований
Получение амфотерных гидроксидов
Ввиду того что амфотерный гидроксид проявляет свойства основания и кислоты, его можно получить с помощью реакций обмена и как основание
и как кислоту
Эти превращения происходят потому, что все амфотерные гидроксиды нерастворимы в воде.
Щелочь или кислоту нельзя брать в избытке, поскольку амфотерный гидроксид реагирует с обоими соединениями. Например, при взаимодействии натрий цинка с избытком сульфатной кислоты вместо цинк гидроксида образуется цинк сульфат:
Некоторые амфотерные гидроксиды можно получить реакцией обмена между двумя солями в растворе, если одна из солей — продуктов реакции — разлагается водой (такие сведения имеются в таблице растворимости):
Выводы:
Щелочи получают взаимодействием соответствующих металлов или оксидов с водой.
Общий метод получения растворимых и нерастворимых оснований, а также амфотерных гидроксидов основан на реакции обмена между щелочью и солью в растворе. Амфотерные гидроксиды, кроме того, получают взаимодействием соответствующих солей с кислотами.
Химические свойства оснований
О действии растворов оснований на индикаторы, взаимодействие оснований с кислотными оксидами и кислотами вы узнали ранее. Вспомним соответствующие реакции.
Действие оснований на индикаторы
(Это свойство имеют лишь основания, растворимые в воде, то есть щелочи.) В растворе щелочей лакмус приобретает синий цвет, метиловый оранжевый — желтый, а фенолфталеин — малиновый. Универсальный индикатор в разбавленном растворе щелочи имеет зеленую окраску, в концентрированном — синюю и сине-фиолетовую.
Взаимодействие с кислотными оксидами
Щелочи взаимодействуют с кислотными оксидами, образовывая соль кислоты, которой отвечает взятый для реакции оксид, и воду:
Взаимодействие с кислотами (реакция нейтрализации)
Щелочи (уравнение а) и нерастворимые основания (уравнение б) взаимодействуют с кислотами, образуя соль и воду:
Следующие два свойства оснований вам еще неизвестны, поэтому для их изучения проведем химический эксперимент.
Взаимодействие щелочей с растворами солей
(Реакция происходит в том случае, если по крайней мере один из продуктов реакции выпадает в осадок или выделяется в виде газа.)
Опыт 1. Нальем в сосуд раствор сульфата железа
Отношение оснований к нагреванию
Щелочи устойчивы к нагреванию. Нерастворимые основания при нагревании разлагаются на оксид металла и воду.
Опыт 2. Сухую пробирку на 1/4 наполним гидроксидом меди
В том, что одним из продуктов этой реакции будет вода, можно удостовериться, подержав холодный предмет (например, стеклянную пластину) около отверстия пробирки.
Чтобы закрепить знания о химических свойствах оснований, выполните лабораторные опыты 3, 4, 5, 6. Прежде чем приступить к их выполнению, ознакомьтесь с мерами предосторожности во время работы со щелочами и неуклонно выполняйте их.
Меры предосторожности во время работы со щелочами:
Твердые щелочи и их растворы разъедают ткань, бумагу, вызывают ожоги кожи, глаз, что очень опасно. Поэтому обращаться с ними нужно осторожно: гранулу щелочи (вспомните, что это твердые вещества) ни в коем случае не брать руками; не разливать растворы; следить, чтобы раствор не попадал на открытые участки кожи, в глаза, на одежду, парту, книги, тетради. Вам понадобятся защитная одежда (халат, передник) и защитные очки. Посуду с раствором щелочи следует держать закрытой, чтобы она не реагировала с углекислым газом воздуха.
Если вы разлили щелочь, сразу нейтрализуйте ее уксусом. Участок кожи, на который попала щелочь, быстро промойте большим количеством воды. Если щелочь попала в глаза, немедленно промойте их медицинским раствором борной кислоты.
Итоги:
- Щелочи в химическом отношении более активны, чем нерастворимые основания, и имеют такие типичные свойства:
- Типичными химическими свойствами нерастворимых оснований является взаимодействие с кислотами и разложение при нагревании:
- Реакция нейтрализации свойственна и щелочам, и нерастворимым основаниям.
- Взаимодействие щелочи с раствором соли происходит, если среди продуктов реакции есть нерастворимые вещества.
«Для того, чтобы спаять две железные части какого-либо предмета, необходимо поверхность металла тщательным образом очистить от ржавчины, в состав которой входит гидроксид железа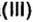
Чтобы во время травления с кислотой взаимодействовала только ржавчина, а не железо, из которого изготовлен предмет, в травильный раствор добавляют ингибиторы — вещества, которые действуют противоположно катализаторам. Они замедляют реакции, а то и совсем их прекращают. Ингибитором реакции между железом и соляной кислотой является органическое вещество уротропин.
Если вы хотя бы раз пользовались горючим под названием «сухой спирт», то имели дело со смесью уротропина с небольшим количеством парафина. Это горючее удобно тем, что быстро зажигается, легко гаснет и почти не оставляет пепла.
Понятие об амфотерных гидроксидах
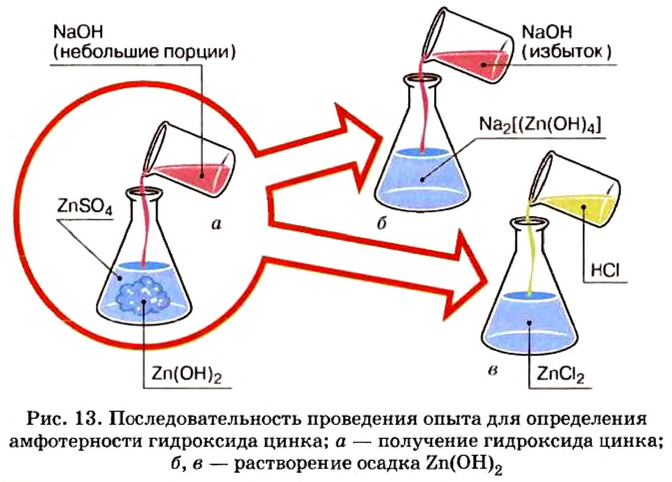
Щелочи и большинство нерастворимых оснований взаимодействуют с кислотами и не взаимодействуют с представителями своего класса. Кислоты взаимодействуют с основаниями и не взаимодействуют с другими кислотами. Проверив экспериментально, с какими веществами данное вещество взаимодействует, а с какими — нет, можно сказать: к классу оснований или к классу кислот оно относится. Это общее правило. Однако оно имеет исключение, понять которое нам помогут опыты с гидроксидом цинка.
По способности растворяться в воде это вещество принадлежит к нерастворимым основаниям. Единственным способом получения нерастворимых оснований является взаимодействие растворимой соли соответствующего металла с раствором щелочи. Одним из продуктов этого взаимодействия будет нерастворимое основание.
Опыт 1. Нальем в колбу раствор сульфата цинка и добавим к нему небольшими порциями раствор гидроксида натрия, пока в колбе не образуется белый осадок (рис. 13):
Образовавшийся осадок разделим, поместим в 2 колбы и проведем следующие опыты.
Опыт 2. В первую колбу с гидроксидом цинка добавим соляной кислоты. Осадок сразу исчезает, что является признаком химического явления:
Обратимся к таблице растворимости и увидим, что образовавшаяся соль хлорид цинка — растворимое в воде соединение.
Произошла реакция нейтрализации, в которой гидроксид цинка проявил свойства основания.
Опыт 3. Во вторую колбу с гидроксидом цинка добавим раствор гидроксида натрия. Наблюдение показывает, что, как и в опыте с соляной кислотой, осадок исчез. Следовательно, осадок прореагировал с избытком щелочи (в опыте 1 мы прекратили доливать раствор щелочи, как только образовался осадок. При избыточном добавлении щелочи мы успели бы лишь визуально зафиксировать появление и исчезновение осадка).
Запишем уравнение проведенной реакции:
Образовалась соль натрия, в которой вместо привычного кислотного остатка есть остаток, содержащий один атом цинка и четыре (тетра — четыре) гидроксильные группы. Остаток такого вида записывают в квадратных скобках.
В этой реакции гидроксид цинка сыграл роль кислоты, потому что металлический элемент цинк после реакции вошел в состав кислотного остатка.
Гидроксиды, которые образуют соль при взаимодействии как с кислотой, так и со щелочью, называют амфотерными гидроксидами.
Повторите материал об амфотерных оксидах (§ 13) и составьте формулы амфотерных гидроксидов, которые им отвечают.
Амфотерные гидроксиды реагируют со щелочами не только в растворе, но и в расплаве:
Образовавшаяся соль имеет двухвалентный кислотный остаток 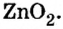
Проведенные опыты свидетельствуют, что разделение сложных неорганических веществ на оксиды, кислоты, основания и
соли не лишено исключений. Бывают вещества со смешанными свойствами, например амфотерные гидроксиды.
Применение оснований:
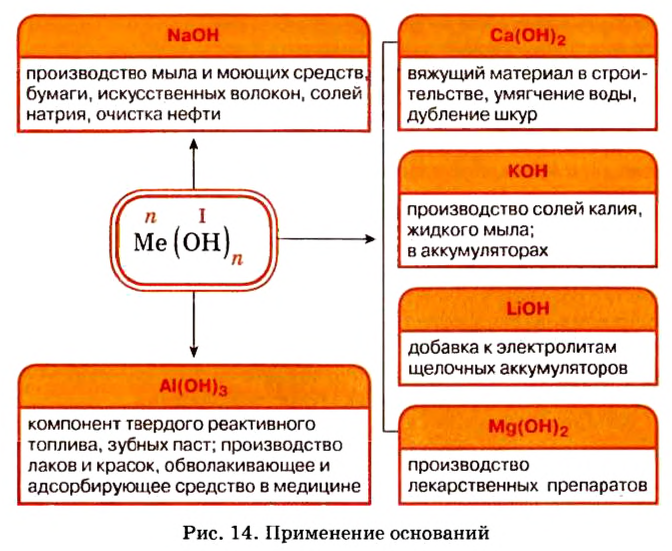
Представители этого класса неорганических веществ в природе отсутствуют. Но потребность в них существует, поэтому их получают специально. Наибольшее практическое значение имеют щелочи гидроксид натрия и гидроксид калия. Применение этих и некоторых других оснований показано на рисунке 14.
Итоги:
Получение оснований
Растворимые основания (щелочи) получают взаимодействием металла или его оксида с водой.
1. Взаимодействие активных металлов с водой приводит к образованию щелочей и выделению водорода:
(К какому типу относятся эти реакции?)
2. Взаимодействие оксидов активных металлов с водой завершается образованием растворимого в воде гидроксида — щелочи:
(Какой это тип реакции?)
3. В промышленности щелочи получают электролизом водных растворов бескислородных кислот. Этот способ вы будете изучать в следующем классе.
4. Нерастворимые основания получают действием раствора щелочи на растворимую соль соответствующего металла:
Классификация, номенклатура и получение оснований
Поместите в керамический тигель немного карбоната кальция (известняка) и в течение 10 минут раскалите на огне спиртовки.
После того как тигель остынет, влейте поверх него немного дистиллированной воды, Затем помешивайте стеклянной палочкой и проверьте красной лакмусовой бумагой. Что вы наблюдаете? Обсудите свои соображения с товарищами. Запишите уравнения реакций.
Сложные вещества, в составе которых содержатся одна или несколько гидроксильных групп (ОН), соединенных с атомами металлов, называются основаниями. Основания обозначаются общей формулой Me(OH)n
Гидроксильная группа ОН всегда одновалентна. Число гидроксильных групп соответствует валентности металла.
Классификация:
Основания классифицируются по своей растворимости в воде и кислотности.
Растворимые в воде основания называют щелочами. Кроме Li, Na, К, Rb, Cs, Ca, Sr, Ba, гидроксиды других металлов не растворяются или очень мало растворяются в воде. Часть нерастворимых в воде оснований обладает амфотерными (двойственными) свойствами.
Основания, вступающие в реакцию как с кислотами, так и с щелочами, образуя соль и воду, называются амфотерными основаниями: Zn (ОН)2, Be (OH)2, Al (OH)3, Fe (OH)3.
Число гидроксильных групп в составе оснований определяет их кислотность.
Номенклатура:
При наименовании оснований по международной номенклатуре, если металл, образующий основание, имеет постоянную валентность, то вначале указывается слово «гидроксид», а затем название металла. Если же металл обладает переменной валентностью, то после слова «гидроксид» и названия металла валентность отмечают римскими цифрами в скобках.
| Основания металлов с постоянной валентностью | Основания металлов с постоянной валентностью | ||
| Гидроксид металла | Международное название | Гидроксид металла | Международное название |
| Mg(OH)2 | Гидроксид магния | Pb(OH)2 | Гидроксид свинца (II) |
| NaOH | Гидроксид натрия | Cr(OH)3 | Гидроксид хрома (III) |
| Al(OH)3 | Гидроксид алюминия | CuOH | Гидроксид меди (I) |
Графические формулы оснований:
Получение растворимых в воде оснований
Получение в лабораторных условиях.
При взаимодействии активных металлов (щелочных металлов Li, Na, К, Rh, Cs и щелочноземельных металлов Ca, Sr, Ba) с водой. Эти реакции протекают в обычных условиях.
металл + вода → щелочь + H2 ↑
2Li + 2HОH → 2LiOH + H2 ↑
При взаимодействии в обычных условиях гидридов щелочных (NaH3 КН) и щелочноземельных металлов(CaH2, BaH2) с водой.
гидрид металла + вода → щелочь + H2↑
NaH + H2O → NaOH + H2↑
CaH2 + 2H2O → Ca(OH) 2 + 2H2
При взаимодействии оксидов щелочных и щелочноземельных металлов с водой.
оксид металла + вода → щелочь
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Получение нерастворимых в воде оснований
При добавлении в раствор растворимой соли среднеактивных и пассивных металлов щелочи. Получение растворимых в воде оснований этим методом возможно в том случае, если в результате реакции получится нерастворимая соль.
FeCh + ЗКОН → Fe(OH)3↓ + 3 KCl
Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
Получение в промышленности
Путем воздействия постоянного электрического тока на водные растворы хлоридов щелочных и щелочноземельных металлов.
2NaCl + 2H2O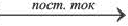
Физические и химические свойства оснований
Определите основания по цвету раствора и осадка в пробирке. Какие физические и химические свойства имеют основания?
Физические свойства: В обычных условиях щелочи это растворимые в воде твердые вещества белого цвета. Некоторые нерастворимые в воде основания имеют другие цвета. Cu(OH)2 голубого, CuOH желтого, Fe(OH)3 бурого, Fe(ОН)2 зеленовато-бурого, Сг(ОН)3 серовато-зеленого цвета.
Все щелочи бывают скользкие как мыло. При растворении в воде они образуют бесцветный раствор.
На рисунке показывается, как меняется цвет индикаторов под действием щелочей. Нерастворимые в воде основания не меняют окраску индикаторов.
Слово «индико» в переводе с латинского означает «показываю», «определяю». Индикаторы это сложные органические соединения. Для определения щелочей (а также кислот) используют такие индикаторы, как лакмус, фенолфталеин и метилоранж.
Химические свойства: Взаимодействие оснований с кислотами (реакция нейтрализации). Для всех оснований характерным химическим свойством является их взаимодействие с кислотами. При взаимодействии кислот с основаниями образуются соль и вода.
Cu(OH)2 + 2HNO3 → Cu(NO3)2 +2H2O
 |
Нальем в химический стакан (или колбу) на 1/4 раствора гидроксида натрия и добавим к нему 1 2 капли лакмуса. Затем к полученному раствору будем прикатывать раствор соляной кислоты. Понаблюдайте, как меняется цвет. Запишите уравнение реакции. |
Взаимодействие щелочей с амфотерными металлами. Из металлов щелочи взаимодействуют только с амфотерными металлами (Be, Zn, Al), при этом образуется соль и выделяется водород.
Zn+ 2NaOH 
2Al + 2NaOH + 2H2O
Взаимодействие щелочей с неметаллами. Щелочи взаимодействуют с целым рядом неметаллов (CL, Br2), образуя соль и воду. Лишь при взаимодействии с кремнием выделяется водород.
Si+ 2NaOH +H2O
Щелочам и нерастворимым в воде основаниям присущи и отличающие их друг от друга химические свойства.
Взаимодействие щелочей с кислотными оксидами. Щелочи вступают в реакцию с кислотными оксидами, а нерастворимые в воде основания не вступают в такую реакцию. 1 моль таких кислотных оксидов, как CO2, S02, SO2, вступает в реакцию соединения с 1 молем однокислотной щелочи.
CO2+NaOH → NaHCO3
Хранить щелочи в открытой посуде нельзя. Потому что при вступлении в реакцию с углекислым газам воздуха образуются соответствующие карбонаты.
В этих реакциях даже в том случае, если кислотного оксида берется в избытке, реакция соединения всё равно происходит. При избытке щелочи, например, в соотношении молей 1:2, получится нормальная соль и вода.
CO2 + 2NaOH → Na2CO3 +H2O
Такие кислотные оксиды, как CO2, SO2, SO2, в зависимости от мольного соотношения, вступают в различные реакции с двухкислотными щелочами, при этом получаются различные продукты.
CO2 + Ca(OH)2 → СаСО3↓ + H2O 2CO2 + Ca(OH)2 → Ca(HCO3)2
Из кислотных оксидов NO2 при взаимодействии с щелочами образует две различные соли.
2NO2 + 2NaOH → NaNO3 + NaNO2 +H2O
Взаимодействие щелочей с амфотерными оксидами и гидроксидами. Щелочи также взаимодействуют с амфотерными оксидами и гидроксидами, образуя соль и воду.
Разложение оснований. В то время как щелочи не разлагаются, нерастворимые в воде основания при нагревании разлагаются. Самыми неустойчивыми основаниями являются гидроксиды серебра и ртути. Они подвергаются разложению при комнатной температуре.
Hg(OH)2 → HgO+ H2O
Задача:
При размешивании растворов, как показано на рисунке, то в I сосуде красный цвет лакмуса превратится в голубой, а во II сосуде голубой цвет превратится в красный. На основе этих данных определите, какое из веществ X, Y, Z является кислотой, а какие основанием?
| Кислота | Основание |
| A) X, Y | Z |
| В) Y, Z | X |
| С) Y | X, Z |
| D) Z | X, Y |
| Е) X | Y, Z |
Решение: Если в I сосуде красный цвет лакмуса превращается в голубой, то Х→кислота, a Y→ щелочь.
А во II сосуде голубой цвет лакмуса превращается в красный, значит, Z→ щелочь, a X→ кислота.
Ответ: E
Задача:
Какие выражения верные, если в результате реакции получается нерастворимая в воде соль?
1) Формула полученной соли: YxAb
2) Получится х+b моль Н2О
3) x
4) Продукты реакции проводят электрический ток
5) Полученный в реакции v (H2O)=x=b
| Вступившие в реакцию вещества | v (моль) |
| HxA кислота | a |
| Y(OH)b основание | a |
Решение: HxA + Y(OH)b→ YxAb+ xH2O (или b H2O).
Ответ: 1:5. Согласно условиям, поскольку соль YxAb нерастворимая в воде соль, то она не проводит электрический ток.
Задача:
Что можно определить на основе таблицы?
1) Массу оксида
2) Ar (X)
3) Степень окисления X в оксиде.
| Вещества, полностью вступившие в реакцию | Продукт реакции | |
| X | O2 | XO |
| 4 г | 1,6 г |
Решение:
m(ХО) = 4+1,6 = 5,6г; 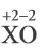
Ответ: 1,2,3
Задача:
| Вещества, вступившие в реакцию, и их мольное количество | Масса полученной соли (в г) | N (атом) в молекуле полученной соли (в целом) | |
| Fe(OH)3 | HNO3 | ||
| 1 | xl | yl | z1 |
| x2 | y2 | z2 | |
| x3 | y3 | z3 |
| 1 | 2 | |
A) х1 х2 х2 х3 х3 |
z1 z2 z2 z3 z3 |
|
В) х3 х2 х2 х1 х1 |
z1 z2 z2 z3 z3 |
|
С) х1 х2 х2 х3 х3 |
z3 z2 z2 z1 z1 |
|
D) x2 x1 x1 x3 x3 |
z2 z1 z1 z3 z3 |
|
Е) х3 х2 х2 х1 х1 |
z3 z2 z2 z1 z1 |
Если y3





Решение:
Ответ: E x3



- Кислоты в химии
- Соли в химии
- Хлор в химии
- Сера в химии
- Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса
- Железо как химический элемент
- Озон как химический элемент
- Оксиды в химии