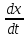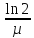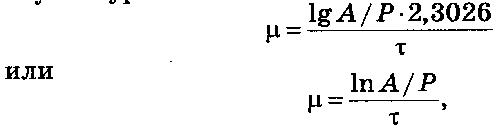Определение
фаз и стадий развития микробной популяции
в питательной среде в условиях периодичной
культуры имеет не только теоретическое
но и большое практическое значение.
Так, определяя режимы хранения микробов,
рекомендуется использовать культуры
в конце фазы логарифмического роста,
поскольку они обладают наибольшей
жизнеспособностью. Для изготовления
вакцин, диагностикумов и любых антигенов
используют микробные культуры на
определенной фазе кривой роста.
Изучение
процесса развития микробной популяции
в периодической системе культивирования
фактически является началом
научно-практической работы по
микробиологическому синтезу тех или
иных продуктов. С этой целью определяется
динамика накопления биомассы, или
целевого продукта метаболизма, а так
же потребление исходного основного
сырья (субстрата). Для этого периодически
берут пробы из развивающейся культуры
с частотой, обеспечивающей возможность
установления основных фаз развития
микробной популяции. Заканчивают
исследования после прекращения роста
микробной культуры и максимального
накопления целевого продукта.
Если
при сравнении параметров кривых роста
число микроорганизмов (или их биомассы)
и накоплением целевого продукта имеется
прямая связ, то это свидетельствует о
результате биосинтеза его в экспоненционную
фазу. Такой продукт микробного метаболизма
называют первичным. При отсутствии
такой корреляции целевой продукт обычно
синтезируется в стационарной фазе и
фазе отмирания, т.е. рост микробов
заторможен и выросшая биомасса может
еще перерабатывать оставшийся
неиспользованный субстрат. Этот продукт
относят ко второй фазе, а сам процесс
синтеза его нередко имеет катаболитический
характер и связан с возникновением
экстремальных условий для микробной
популяции. Но иногда целевой продукт
второй фазы начинает синтезироваться
еще в лог-фазе, так что подразделение
процессов на одно- и двухфазные не носит
абсолютного характера.
Наличие
вторичных продуктов (метаболитов) в
отличие от первичных в большинстве
своем для жизни микроба-продуцента
необязательно. Типичными продуктами
второй фазы роста культур являются
антибиотики. Вторичными могут быть и
продукты энергетического метаболизма.
Например, у некоторых бродильных
микроорганизмов продуктами первичного
метаболизма углеводов часто являются
органические кислоты, но при ингибировании
роста, создающимися условиями среды,
вместо них образуются нейтральные
вещества – спирты, кетоны, являщиеся
часто целевыми продуктами. Такая
двухразность брожения была открыта
В.Н.Шапошниковым и распространена затем
на другие процессы микробного биосинтеза.
Во
вторую фазу может осуществляться и
сверхсинтез продуктов первой фазы
(например, витаминов).
При
культивировании микроорганизмов, с
какой бы целью оно не проводилось, важным
является определение таких характеристик,
как эффективность или скорость роста,
и экономический коэффициент культивирования,
или выход биомассы.
Скорость
роста характеризуется чаще всего
удельной скоростью роста, обозначаемой
М. Удельная скорость роста (µ)
– отношение числа или веса (в граммах)
образовавшихся за единицу времени
клеток к общему числу или весу (в граммах)
клеток. Обычно µ
выражают в доле прироста за 1 час. Таким
образом,
µ
=
*
где
dx
– прирост биомассы за единицу времени
= Х2-Х1
dt
–
промежуток времени, за который определяется
dx;
х
– общее число клеток на момент времени
T2.
Удельная
скорость роста микроорганизмов, когда
это необходимо рассчитывается для любой
фазы развития периодической культуры,
но чаще всего она определяется для фазы
логарифмического роста, в которой кривая
роста имеет линейный характер.
Максимально
возможную скорость роста культуры в
данных условиях обозначают µ
ш.
Очевидно, что µ,
определенная в фазу логарифмического
роста стремится к µ
м.
Иногда
бывает необходимым определять валовую
(общую) скорость роста V,
которая характеризует абсолютный
прирост биомассы за единицу времени:
V=
Как
µ
так
и V
характеризуют
данную культуру в данных условиях
культивирования и не являются
количественной характеристикой штамма.
Скорость
роста может характеризоваться также
временем удвоения количества биомассы
или числа клеток – g
(или
временем генерации):
g
= tудв.
=
=

где
ln
– натуральный логарифм.
Экономический
коэффициент культивирования или выхода
биомассы обозначают «Y»
и определяют как отношение веса (в
граммах) или числа образованных клеток
к весу (в граммах) или концентрации
потребленного питательного субстрата.
Y=
где
— увеличение
количества биомассы, соответствующее
потреблению субстрата в количестве

У
периодических культур определяется
средняя величина за период роста. Вычтя
из количества выросшей биомассы «Х»
количество посевного материала «Х0»
и поделив количество потребленного
питательного вещества, получим:
Yср.
=
где
S0
–
концентрация питательного вещества в
исходной среде;
S
–
остаточная концентрация питательного
вещества.
Экономический
коэффициент может определяться за
резные сроки культивирования. Обычно
конкретный штамм характеризуют по
Yср.
=
в
период фазы логарифмического роста.
При замедлении скорости роста в лог –
фазу вследствие недостатка какого –
либо компонента питательной среды
(лимитирования) или из-за накопления
неблагоприятных для роста метаболитов
в среде (ингибирования) экономический
коэффициент снижается. Экономический
коэффициент может рассчитываться в
отношении потребления любого субстрата,
прежде всего углеродного, а также и в
отношении кислорода и вообще любого
компонента питания.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Расчет удельной скорости роста популяции: сопоставление определения и модели
Институт проблем передачи информации РАН
127994 Москва, ГСП-4, Большой Каретный пер., 19
e-mail: da_yoronov@yahoo.com
Показано, что известное уравнение r = ln[N(t2)/N(t1)]/(t2-t1) есть определение среднего значения удельной скорости роста популяции r на произвольном интервале времени t2-t1 и при произвольном законе изменения ее численности N(t). Тем самым распространенная точка зрения, что это уравнение пригодно лишь для экспоненциально меняющихся популяций, слишком ограничительна. Принципиально иной подход связан с расчетом r согласно демографической модели, реализуемой в виде уравнения Эйлера-Лотки или матриц Лесли. Модель требует одновременного выполнения нереалистических для природной популяции допущений: экспоненциального изменения ее численности, устойчивой возрастной структуры, неизменности во времени зависимых от возраста рождаемости и смертности. Если для расчета r по определению требуются данные об изменении численности популяции во времени, то для расчета с помощью модели необходимы демографические таблицы рождаемости и смертности, тогда как данные о динамике численности не нужны. На примере данных об американском женьшене показано, что оценки r согласно определению и модели могут приводить к существенно различающимся результатам.
ГЛАВА 5. РОСТ И РАЗМНОЖЕНИЕ МИКРООРГАНИЗМОВ
Постоянно осуществляемый микроорганизмами синтез клеточных компонентов стимулирует рост клеток и последующее их размножение. Рост клеток — это процесс увеличения размеров, объема, массы каждой отдельной особи в ходе индивидуального развития, обусловленный синтезом клеточного материала. Рост начинается после деления клетки, которая быстро достигает стадии зрелости, а затем приступает к размножению или переходит в стадию покоя. Рост характерен для всех групп микроорганизмов, кроме вирусов. Его изучают на изолированных клетках.
Размножение микроорганизмов — процесс самовоспроизведения, обеспечивающий сохранение вида. Способы и скорость размножения обусловлены геномом микроба и соответствием условий обитания его генетическим потребностям. Способы размножения у микроорганизмов разнообразны: бинарное деление — у большинства бактерий, почкование, спорообразование, половой процесс и др. — у грибов и дрожжей, особые способы размножения — у простейших (множественное деление, половое и др.).
При бинарном делении, инициатором которого является кольцевая ДНК бактерии, прикрепленная к определенному участку ЦПМ, из одной бактериальной клетки без предварительного обмена генетической информацией образуются две равноценные дочерние особи. Репликация ДНК наступает в определенной фазе роста под контролем гена-регулятора и гена- репликатора. Вновь образованная ДНК оказывается прикрепленной к соседнему участку ЦПМ. Между участками прикрепления исходной и новообразованной ДНК строго по экватору формируется перетяжка (у грамотрицательных бактерий) или перегородка (у грамположительных бактерий). После разделения дочерние клетки расходятся или формируют колониальные организмы в виде цепочек, гроздьев, пакетов и др.
От роста клеток следует отличать рост популяции — необратимое увеличение количества живого вещества (биомассы), обусловленное увеличением клеточной массы и количества клеток в единице объема питательной среды. Результаты количественного изучения роста могут быть представлены более информативно и точно, если анализируются различные параметры роста: удельная скорость роста, лаг-период, экономический коэффициент, метаболический коэффициент, урожай биомассы и др.
5.1. Кривая роста микроорганизмов в периодических условиях
Для роста биомассы в культуре необходимы следующие условия:
а) жизнеспособность засева;
б) наличие источника энергии;
в) внесение пищевых добавок, содержащих все компоненты, необходимые для синтеза биомассы;
г) отсутствие в среде ингибиторов, подавляющих рост клеток;
д) поддержание в среде подходящих физико-химических условий.
При внесении бактерий в питательную среду они обычно растут до
тех пор, пока содержание какого-нибудь из необходимых им компонентов среды не достигнет минимума, после чего рост прекращается. Если на протяжении этого времени не добавлять питательных веществ и не удалять конечных продуктов обмена, то получим так называемую периодическую культуру (популяцию клеток в ограниченном жизненном пространстве). Рост в такой «закрытой системе» подчиняется закономерностям, действительным как для одноклеточных, так и для многоклеточных организмов.
Кривая, описывающая зависимость логарифма числа живых клеток от времени, называется кривой роста. Типичная кривая роста имеет S-образную форму и позволяет различать несколько фаз роста, сменяющих друг друга в определенной последовательности. Она включает начальную (или лаг-) фазу; фазу ускорения роста; экспоненциальную (или логарифмическую), стационарную фазу; фазу замедления роста и фазу отмирания (рис. 5).
Рис. 5. Кривая роста микроорганизмов при периодическом культивировании: I — лаг-фаза; II — фаза ускорения роста; III — фаза экспоненциального роста; IV — фаза замедления роста; V -стационарная фаза; VI — фаза отмирания культуры
Начальная фаза. Эта фаза начинается с момента посева материала (внесения инокулята) до достижения культурой максимальной скорости роста. Продолжительность этой фазы зависит главным образом от объема и возраста инокулята, предшествовавших условий культивирования, а также от степени пригодности для роста выбранной среды. Внесение небольшого объема инокулята в большой объем свежей среды может привести к диффузии из клеток витаминов, кофакторов и ионов, которые необходимы для поддержания активности многих внутриклеточных ферментов. С увеличением возраста инокулята и при переносе клеток из бедной среды в богатую лаг-фаза удлиняется.
Если в качестве инокулята использована старая культура (в стационарной фазе роста), то клеткам придется сначала приспособиться к новым условиям путем синтеза РНК, образования рибосом и синтеза ферментов. Если в новой среде источники энергии и углерода отличаются от тех, что были в предшествующей культуре, то приспособление (адаптация) к новым условиям может быть связана с синтезом новых ферментов, которые ранее не были нужны и поэтому не синтезировались. Образование новых, адаптивных ферментов индуцируется новым субстратом. Причем время, необходимое для синтеза оптимального количества ферментов, может составлять от 10 мин до нескольких часов. У некоторых видов организмов индукция ферментов для использования новых источников углерода и энергии не происходит до тех пор, пока в среде есть хоть малые количества первоначального источника углерода и энергии.
Наглядным примером влияния субстрата на синтез ферментов служит так называемая диауксия. Это явление двухфазного роста или двойного цикла роста наблюдается на средах, содержащих смесь питательных веществ. Например, из смеси глюкозы и лактозы Е. coli поглощает в первую очередь глюкозу. Глюкоза индуцирует в клетках сначала синтез ферментов, которые нужны для ее использования, и одновременно репрессирует (подавляет) синтез ферментов, необходимых для использования лактозы. Эти последние ферменты образуются лишь после того, как вся глюкоза будет израсходована. Такие регуляторные процессы объясняют наличие двух начальных фаз (рис. 6).
Рис. 6. Рост Е. coli в среде с различными сахарами (диауксия)
При оценке роста могут наблюдаться определенные отклонения от идеальной формы кривой роста. Если бактериальную массу измеряют по мутности, то часто наступлению стационарной фазы предшествует небольшое уменьшение оптической плотности. Это может быть артефактом, вызванным изменением отношения биомассы к оптической плотности. Другим отклонением является более быстрое увеличение числа организмов во время первого удвоения, что может быть обусловлено синхронным делением популяции одноклеточных организмов. Третий вариант — диауксия.
Количественное изменение состава бактериальной клетки во время начальной фазы роста сильнее всего затрагивает РНК: ее содержание повышается в 8-12 раз. Это указывает на участие РНК и рибосом (состоящих из РНК и белка) в синтезе ферментных белков.
Лаг-период может быть связан с инактивацией некоторых ингибиторов, присутствующих в среде. Такими ингибиторами иногда являются микроэлементы. Их токсическое действие связано с возможным образованием комплексов между входящими в состав питательной среды аминокислотами и ионами металлов. Токсическим свойством обладают органические кислоты, при этом с увеличением рН токсичность органических кислот уменьшается. Как ингибитор может вести себя субстрат, и тогда лаг-период будет зависеть от времени, необходимого для уменьшения концентрации субстрата до значений, при которых возможна максимальная скорость роста. Ингибирующее влияние на рост могут оказывать продукты метаболизма в инокуляте. Например, некоторые представители Lactobacillaceae при пересеве из анаэробной среды в аэробную могут накапливать перекись водорода, являющуюся сильным ингибитором роста. Перекись водорода индуцирует образование пероксидазы, которая удаляет перекись водорода. Лаг-период, обусловленный перекисью водорода, может увеличиваться с увеличением размера инокулята, поскольку образование перекиси водорода пропорционально концентрации клеток. Если инокулят состоит из споровых форм, то лаг-период, предшествующий вегетативному росту, соответствует времени прорастания спор.
Таким образом, существует множество причин, вызывающих задержку роста. Для того чтобы избежать или свести к минимуму лаг-период, инокулят следует брать из культуры, находящейся в конце логарифмической фазы, в условиях, как можно более близких к среде, используемой для пересева. Размер инокулята обычно следует брать по возможности больше.
Экспоненциальная (логарифмическая) фаза роста характеризуется постоянной максимальной скоростью деления клеток, которая зависит от вида бактерий и питательной среды. Энтеробактерии делятся через каждые 15-30 мин, у многих почвенных видов оно достигает 60-150 мин, а у Nitrobacter — даже 5-10 ч. Величина клеток и содержание в них белка у многих бактерий тоже остаются в экспоненциальной фазе постоянными. То есть в этом случае бактериальная культура состоит из «стандартных клеток». Если число клеток, содержание в них белка и их сухая биомасса увеличиваются с одинаковой скоростью, то за ростом культуры можно следить по одному из этих показателей.
Поскольку в экспоненциальной фазе скорость деления клеток относительно постоянна, эта фаза наиболее удобна для определения скорости деления клеток (скорости роста), изучения влияние факторов среды (рН, окислительно-восстановительного потенциала, температуры, аэрации и т. д.). Кроме того, в этой фазе определяют пригодность различных субстратов, а также следят за увеличением числа клеток или за мутностью (экстинкцией) клеточной суспензии.
Стационарная фаза наступает, когда число клеток перестает увеличиваться. Скорость роста зависит от концентрации субстрата — при уменьшении этой концентрации, еще до полного использования субстрата, она начинает снижаться. Поэтому переход от экспоненциальной фазы к стационарной происходит постепенно. Скорость роста может снижаться не только из-за нехватки субстрата, но также из-за большой плотности бактериальной популяции, низкого парциального давления О2 или накопления токсичных продуктов обмена; все эти факторы вызывают переход к стационарной фазе.
В ранней стационарной фазе размер бактериальной клетки достигает минимума. В поздней стационарной фазе (а также в фазе отмирания) часто наблюдаются искривленные или разбухшие клетки, называемые «инволюционными формами». Это связано либо с повреждениями клеток литическими ферментами клеточных стенок или плазматических мембран, либо слабой регуляцией синтеза клеточных компонентов. У грамположительных бактерий в стационарной фазе обычно наблюдается потеря способности клеток окрашиваться по Граму. Сопротивляемость бактерий физическим и химическим стрессам (влиянию гипотонической среды, внезапной смене температур) в стационарной фазе выше, чем в логарифмической. Для некоторых бактерий в стационарной фазе характерно образование спор.
В конце логарифмической фазы наблюдается синтез первичных метаболитов, то есть продуктов, необходимых для роста и выживания. В стационарной фазе синтезируются вторичные метаболиты — продукты, которые не требуются для роста и не существенны для выживания, однако они выполняют полезные функции и часто защищают от действия других конкурирующих микроорганизмов либо подавляют их рост (например, антибиотики). Количество биомассы, достигнутое в стационарной фазе, называют выходом или урожаем. Урожай зависит от природы и количества используемых питательных веществ, а также от условий культивирования.
Фаза отмирания. Гибель клеток во многом является результатом исчерпания запасов энергии в клетке. Клетки перестают делиться, гибнут и распадаются. Количество живых клеток резко уменьшается. Скорость отмирания бактерий варьирует в зависимости от условий и особенностей организма.
5.2. Параметры кривой роста
Основные параметры роста простой периодической культуры микроорганизмов (удельную скорость роста, время генерации, число клеточных делений) определяют в течение экспоненциальной фазы, тогда как максимальная концентрация жизнеспособных клеток в популяции характерна для стационарной фазы.
5.2.1. Удельная скорость роста
Если для роста биомассы в культуре соблюдены необходимые условия, то предполагается, что в период логарифмической фазы роста в течение бесконечно малого промежутка времени dt увеличение биомассы dх должно быть пропорционально количеству биомассы х и интервалу времени, то есть
dх = μх dt, (1)
откуда
dх/dt = μх (2)
Дифференциальное отношение dх/dt выражает скорость роста популяции. Параметр μ, обозначающий скорость роста единицы биомассы (1/х)(dх/dt), называется удельной скоростью роста и измеряется в единицах, обратных времени (1/t). Этот параметр аналогичен сложным процентам. Так, например, удельная скорость роста 0,1 ч-1 эквивалентна скорости 10 % в час.
Если μ постоянна, то интегрирование уравнения (2) дает
1n х = 1n х0 + μt, (3)
где х0 — биомасса в начальный момент времени t=0. Г рафик зависимости 1n х от времени будет иметь вид прямой линии с наклоном μ.
Из уравнения (3) следует, что
1n (х/ х0) = μt (4)
тогда
μ = 1n (х/х0): t, (5)
а
х = х0 е μt (6)
Рост, подчиняющийся этому закону, называется экспоненциальным, или логарифмическим ростом. Основным параметром, характеризующим скорость роста, служит удельная скорость роста. Остальные параметры роста во многих случаях могут быть выражены через удельную скорость роста.
5.2.2. Время удвоения биомассы
Зависимость между удельной скоростью роста и временем удвоения (td) биомассы можно получить, подставив в уравнение (4)
х = 2 х0 и t = td,
тогда
td = ln2 : μ = 0,693 : μ (7)
5.2.3. Степень размножения
Степень размножения определяется отношением х/х0, которое равно еμt. Если биомасса претерпевает п удвоений или генераций, то можно записать:
х/х0 = 2n (8)
Таким образом,
n = 3,32 log(x/x0) (9)
5.2.4. Экономический коэффициент
Если рост микробной популяции ограничен определенным субстратом, то между начальной концентрацией внесенного в среду лимитирующего субстрата и полученным общим урожаем существует линейная зависимость. Поэтому масса клеток, образованная на единицу лимитирующего субстрата, представляет собой константу — экономический коэффициент, или выход биомассы (Y). Величина Y может быть определена из уравнения:
∆х/∆у = Y, (10)
где ∆х — увеличение биомассы, соответствующее потреблению субстрата в количестве ∆у. Экономический коэффициент, определяется пределом, к которому стремится отношение ∆х/∆у при ∆s —> 0, то есть
Y = dх/ ds (11)
Если х и s — концентрация биомассы и субстрата соответственно, то более строго:
Y = — dх/ ds.
Знак минус вводится потому, что значения х и s изменяются в разные стороны.
Если внешние условия в бактериальной культуре поддерживаются постоянными, то экономический коэффициент тоже будет постоянной, количественно воспроизводимой величиной. Таким образом, если х0 и s0 — начальные концентрации биомассы и субстрата соответственно, а х и s — соответствующие концентрации во время роста в культуре, то
х — х0 = Y (s0 — s) (12)
отсюда
Y = (х — Х0) / (s0 — s) (13)
Экономический коэффициент, измеренный исходя из потребленного органического субстрата, становится показателем эффективности превращения субстрата в бактериальную массу.
5.2.5. Метаболический коэффициент
Скорость потребления субстрата культурой в данный момент времени выражается отношением:
ds/dt = qх, (14)
где х — биомасса, а коэффициент q известен как метаболический коэффициент или удельная скорость метаболизма. Метаболический коэффициент аналогичен ферментативной активности. Если состав биомассы и окружающая среда постоянны, то и д должен быть величиной постоянной.
Для потребления субстрата в небольшой промежуток времени dt можно записать
ds = (μ х : Y) dt, (15)
откуда
ds/dt = μ х/Y (16)
Сравнивая уравнения (16) и (14), становится видно, что
q =μ /Y (17)
Уравнение (17) используется для определения потребностей в субстрате, особенно в кислороде, при различных скоростях роста.
5.2.6. Урожай биомассы
Под урожаем биомассы понимают разность между максимальной и исходной массой бактерий: Х = Хмакс — Х0. Эту величину выражают в граммах сухого вещества.
13.1. УДЕЛЬНАЯ СКОРОСТЬ РОСТА
Для вычисления удельной скорости роста μ служит уравнение
где Р – начальное содержание дрожжей (засев), кг; А – содержание дрожжей в конце цикла, кг; τ – длительность процесса, ч.
В реальном процессе на удельную скорость роста оказывает влияние множество независимых друг от друга факторов: качество питательной среды, конструкция и техническое состояние оборудования, активность засева, колебания температуры, рН среды и концентрации сахара, степень аэрации и др. Поэтому для определения реальной удельной скорости роста в конкретных условиях следует проанализировать результаты производственной деятельности методами математической статистики, с тем чтобы величины А и Р были достоверными.
13.2. БРОДИЛЬНАЯ АКТИВНОСТЬ
13.2.1. ОПРЕДЕЛЕНИЕ ПО СКОРОСТИ СПИРТОВОГО БРОЖЕНИЯ
О скорости брожения судят по количеству углекислоты, выделившейся в единицу времени из определенного объема среды:
С6H12O6 (180 г) → 2CO2 (88 г) + 2CH3CH2OH (92 г).
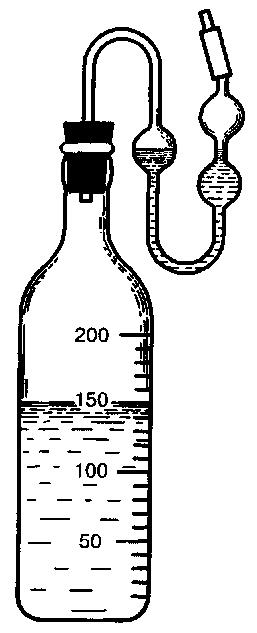
Количество углекислоты устанавливают по убыли веса сосуда, снабженного затвором (рис. 35).
В колбы (или бутыли) наливают 11%-ное неохмеленное сусло. Вносят в сусло исследуемую культуру до 7–10 млн клеток в 1 см3. Количество введенных дрожжей определяют подсчетом клеток под микроскопом с помощью камеры Горяева. Колбы закрывают затворами, взвешивают и оставляют при температуре 28–30°С или температуре, соответствующей технологической. Колбы или бутыли взвешивают ежедневно до прекращения изменения массы.
Рис. 35
Колба с сернокислым затвором для брожения
По разности начальной и конечной масс определяют бродильную активность дрожжей, выражая ее в граммах диоксида углерода, выделившегося из 100 см3 сусла.
Рассчитывают, сколько граммов СO2 выделилось из 1000 см3 среды в 1 ч за каждый интервал времени между взвешиваниями сосуда. Для регистрации результатов можно использовать таблицу 19.
Таблица 19
Динамика выделения СО2 при брожении
Более информативным и технологически верным будет пересчет граммов СO2, выделившихся из 1000 см3 среды в 1 ч на 1 млн клеток засевных дрожжей.***
13.2.2. ОПРЕДЕЛЕНИЕ ПО КОЛИЧЕСТВУ ЭТАНОЛА
Количество этанола, образовавшегося при брожении, определяют оксидиметрическим методом, основанным на окислении этилового спирта до уксусной кислоты и воды смесью бихромата калия с серной кислотой:
3СН3СН2ОН + 2K2Cr2O7 + 8H2SO4 =
= 3СН3СООН + 2Cr(SO4)2 + K2SO4 + 11H2O.
По окончании окисления спирта избыток бихромата оттитровывают раствором соли Мора:
К2Сг2O7 + 6FeSO4(NH4)2SO4 + 7H2SO4 =
= Cr2(SO4)3 + 3Fe2(SO4)2 + 6(NH4)2SO4 + 7H2O + K2SO4.
По количеству бихромата, израсходованного на окисление, вычисляют концентрацию спирта. Наиболее точные результаты метод дает при содержании спирта в жидкости в пределах 1–2%. Поэтому при более высоких концентрациях спирта разбавляют культуральную жидкость, а при меньших – растворы соли Мора и бихромата.
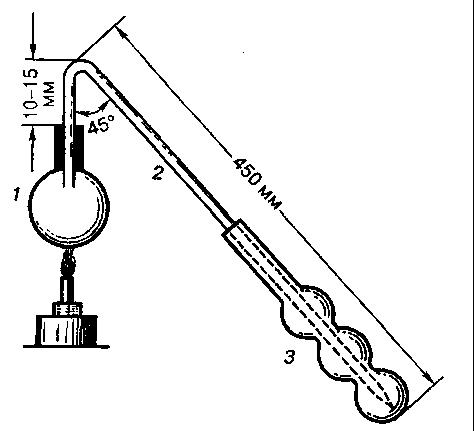
В мерную колбу на 100 см3 помещают 20 см3 культуральной жидкости, освобожденной от клеток декантацией, фильтрованием или центрифугированием. Содержимое колбы доводят до метки дистиллированной водой, перемешивают и берут 10 см3 в круглодонную колбу на 50–75 см3. В трехшариковый приемник наливают 25 см3 раствора бихромата и 10 см3 концентрированной H2SO4. Колбу плотно закрывают резиновой пробкой с отводной трубкой, суженный конец которой должен доходить почти до дна приемника (см. рис. 36). Затем в течение 10–15 мин отгоняют две трети содержимого колбы. Раствор бихромата за это время меняет окраску от оранжевой до грязно-бурой. После отгонки во избежание обратного перебрасывания жидкости из приемника убирают приемник и только потом отставляют горелку.
Содержимое приемника переносят в мерную колбу на 100 см3. Дистиллированной водой споласкивают приемник и отводную трубку, и промывные воды выливают в ту же мерную колбу. После этого раствор в колбе доводят до метки дистиллированной водой, перемешивают, отбирают из него 20 см3 в коническую колбу на 250 см3, добавляют 20 см3 дистиллированной воды и титруют солью Мора.
Рис. 36
Прибор Мартена для определения спирта:
1 – круглодонная колба;
2 – отводная трубка;
3 – приемник
Параллельно ведут контрольное титрование, чтобы определить, сколько соли Мора идет на титрование 5 см3 раствора бихромата. Для этого в коническую колбу помещают 5 см3 раствора бихромата, 2 см3 концентрированной серной кислоты, 30–40 см3 дистиллированной воды и титруют солью Мора. Так как соль Мора нестойкое соединение, контрольное титрование обязательно делают при каждом определении. Конец титрования устанавливают капельной пробой с раствором феррицианида. Для этого на чистую белую фарфоровую или керамическую пластинку стеклянной палочкой наносят каплю титруемой жидкости и рядом из капельницы – каплю раствора феррицианида. Интенсивное синее окрашивание, получаемое при слиянии капель, указывает на конец реакции. Опытный раствор и контроль титруют по два раза. Первое титрование служит для получения ориентировочных результатов, поэтому реакцию титруемой жидкости с раствором феррицианида проводят после добавления каждого миллилитра раствора соли Мора. При втором титровании из бюретки сначала сливают без пробы на индикатор большую часть того количества раствора соли Мора, которое было определено первым титрованием, а затем делают качественную реакцию каждый раз после добавления 0,1 см3 раствора соли Мора.
Количество этанола (г/10 см3) в культуральной жидкости рассчитывают по формуле
где а – см3 раствора соли Мора, пошедшие на титрование контроля; б – см3 раствора соли Мора, пошедшие на титрование опыта; 25 – см3 К2Сг2O7; 5 – разведение культуральной жидкости (20 см3 до 100 см3); 0,01 – грамм этанола соответствует 1 см3 К2Сг2O7.
13.2.3. ОБЪЕМНЫЙ СПОСОБ
Метод основан на том, что состав сусла не всегда одинаков, и определение бродильной энергии дрожжей целесообразнее проверять на растворе какого-либо сахара. Прибор, применяемый для этой цели, состоит из колбочки емкостью 50 см3, присоединенной резиновой трубки, бюретки и уравнительного сосуда. Бюретку и уравнительный сосуд заполняют 20%-ным раствором NaCl, подкисленным ортофосфорной кислотой до рН 1,0. Этот раствор почти не поглощает СO2. В колбочку помещают трехсуточную культуру дрожжей (выращенных на сусло-агаре), промытых и отпрессованных между листками фильтровальной бумаги. В навеске должно содержаться около 0,15 г сухих веществ (определенный вес, например 0,7 г с влажностью около 75%). Затем в колбочку наливают 30 см3 10%-ного раствора сахара (глюкозы), содержащего 0,2% КН2РO4. Колбочку закрывают пробкой и из бюретки вытесняют воздух, пользуясь уравнительным сосудом. Уровень раствора в бюретке устанавливают на ноль. После этого поворотом трехходового крана соединяют емкость колбочки с бюреткой и начинают процесс брожения, который ведут при температуре 20°С в течение 3 ч. Через каждый час уровень жидкости в бюретке отмечают и устанавливают на ноль.
По объему образовавшегося СO2 за 3 ч (по сумме трех объемов) судят о бродильной способности дрожжей. Хорошо бродящие дрожжи за 3 ч образуют около 30 см3 СO2.
13.2.4. МАНОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ БРОДИЛЬНОЙ АКТИВНОСТИ***
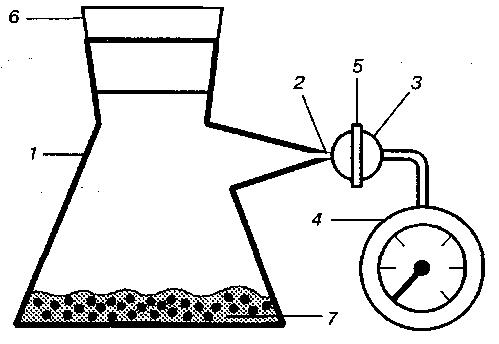
Для определения бродильной активности дрожжей используется прибор, состоящий из колбы (объем 300–500 см3), газоотводной трубки с краном и чувствительного манометра (медицинский, для определения артериального давления) (рис. 37).
Перед началом работы измеряют объем используемой колбы до нижнего края тщательно притертой пробки и объем газоотводной трубки. Для этого заполняют колбу и трубку водой, затем мерным цилиндром измеряют объем вместившейся жидкости.
Воспользовавшись уравнением Менделеева – Клапейрона, определяют необходимую величину давления в свободном объеме используемой колбы. Порядок расчета величины давления описан в пп. 12.4.2.
В колбу вносят 0,7 г отпрессованных на воронке дрожжей, 30 см3 солодового сусла
(8–10% СВ) или 10%-ного раствора сахара и взбалтывают до получения однородной суспензии. Колбу тщательно закрывают и через газоотводную трубку соединяют с манометром. Для уравнивания давления в колбе с атмосферным давлением извлекают подвижную часть краника и сразу помещают на место, тщательно притерев и совместив отверстия. Подготовленный таким образом прибор переносят в термостат при температуре, соответствующей технологической, и регистрируют время, за которое стрелка манометра достигнет необходимой отметки, соответствующей определяемому количеству выделенного диоксида углерода.
Рис. 37
Прибор для брожения:
1 – колба; 2 – газоотводная трубка; 3 – краник; 4 – манометр;
5 – подвижная часть краника; 6– пробка; 7 – дрожжевая суспензия.
П р и м е р. Для оценки бродильной активности пивных и винных дрожжей регистрируется 28–30 см3 СO2. Такое количество газа хорошими дрожжами выделяется не более чем за 3 ч.
13.3. СТЕПЕНЬ СБРАЖИВАНИЯ***
Конечная степень сбраживания является не только важным показателем технологической оценки углеводного состава сусла, но и характеризует физиологические возможности исследуемых дрожжей, имеющие решающее значение в оптимизации технологического процесса.
Метод основан на экспериментальном сбраживании дрожжами субстрата с последующим установлением количества сброженных сахаров.
В зависимости от поставленной задачи и особенностей исследуемой расы дрожжей начальная концентрация СВ в субстрате может колебаться от 15 до 20 и более %.
Для того чтобы исключить влияние состава сусла на результаты эксперимента, можно использовать среду постоянного состава.
Глюкоза
(сахароза, мальтоза)…………………………. 150–200 г
Дрожжевой автолизат…………………………… 5,0 см3
Биотин………………………………………………. 0,02 см3
Вода…………………………………………. до 1000,0 см3
Приготовленный субстрат разлить в бутылки по 200 см3 и туда же внести по 0,5 г отпрессованных на воронке исследуемых дрожжей. Тщательно перемешать до однородной суспензии и инкубировать. На каждую культуру готовить по 10 бутылок и определять степень сбраживания с интервалом 6–12–24 и более часа.
Температурный режим инкубации может быть оптимальным для дрожжей — 28–30°С или же устанавливаться в зависимости от технологических особенностей.
Измерение вести до трех одинаковых результатов, первый из которых считать конечной степенью сбраживания. Перед измерением плотности субстрат фильтровать через бумажный фильтр, возвращая в воронку первые порции.
Конечную степень сбраживания, показывающую количество в сусле сброженных веществ, считают в процентах к их массе в исходном субстрате по формуле
где тсв – массовая доля сухих веществ в начальном субстрате, %; mсв1 – видимая массовая доля сухих веществ в субстрате на момент измерения, %. Регистрируется:
- конечная степень сбраживания;
- скорость сбраживания;
- динамика сбраживания, выраженная графически.
13.4. ПОДЪЕМНАЯ СИЛА
Подъемная сила – основной показатель качества хлебопекарных дрожжей; чем быстрее дрожжи поднимают тесто, тем выше их качество. Хорошие дрожжи поднимают тесто за 60–65 мин. В соответствии с требованиями стандарта подъемная сила товарных дрожжей не должна превышать 75 мин.
Следует помнить, что подъемная сила дрожжей может несколько изменяться в зависимости от влажности и качества муки.
13.4.1. ПОДЪЕМНАЯ СИЛА ПРЕССОВАННЫХ ДРОЖЖЕЙ
Стандартный метод. 280 г пшеничной муки 85%-ного помола помещают в термостат при температуре 35°С не менее чем на 2 ч. Затем подогревают до 35°С 160 см3 2,5%-ного раствора поваренной соли, 5 г анализируемых прессованных дрожжей, отвешенных на технических весах с точностью до 0,01 г, смешивают в фарфоровой чашке с 15–20 см3 подготовленного, как указано выше, раствора поваренной соли до исчезновения комков. Разведенные дрожжи быстро вливают в дежу лабораторной тестомесильной машины с частотой вращения 135 об/мин. Оставшимся раствором соли ополаскивают чашку из-под дрожжей и тоже выливают в дежу. Затем насыпают 280 г согретой муки и включают тестомесильную машину.
Через 5 мин тестомесильную машину останавливают, вынимают тесто, придают ему форму батона и кладут в металлическую форму, также предварительно нагретую в термостате при 35°С и смазанную растительным маслом.
При отсутствии месильной машины тесто замешивают вручную, соблюдая указанный выше режим его приготовления.
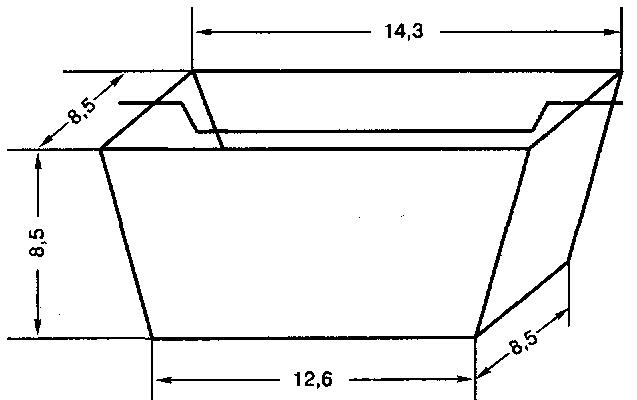
Форма должна иметь в продольном и поперечном разрезах трапецию следующих внутренних размеров (в см): верхние основания 14,3×9,2, нижние – 12,6×8,5, высота – 8,5. На длинные борта ее навешивают поперечную металлическую перекладину, входящую в форму на 1,5 см (рис. 38).
Пробу ставят в термостат с температурой 35°С и фиксируют время. Когда тесто коснется нижнего края перекладины, вновь отмечают время.
Рис. 38
Форма для определения подъемной силы дрожжей
Скоростью подъема теста, или подъемной силой, считают продолжительность (в мин) нахождения теста в форме с момента внесения его до соприкосновения с нижним краем перекладины.
Хорошие дрожжи показывают подъемную силу не более 60–65 мин.
«По шарику». Навеску дрожжей массой 0,31 г перемешать в ступке с 4,8 см3 подогретой до 35°С воды. Добавить 7,0 г муки II сорта и быстро замешать, придав замесу форму шарика, не прилипающего к рукам. Шарик погрузить в стакан с водой температурой 32°С. Стакан поместить в термостат при 32°С.
Регистрировать время от погружения до всплытия шарика.
Хорошие дрожжи показывают подъемную силу не более 25 мин.
Время, затраченное на всплывание шарика (мин), умножают на коэффициент 3,5 и получают величину подъемной силы, определяемую стандартным способом.
13.4.2. ПОДЪЕМНАЯ СИЛА СУХИХ ДРОЖЖЕЙ
К навеске сушеных дрожжей (2,5 г), взятой на технических весах, добавляют 30 см3 водопроводной воды, нагретой до 35°С. Смесь помещают в термостат при температуре 35°С на 30 мин. К размокшим дрожжам добавляют 15 г пшеничной муки II сорта, тщательно размешивают и вновь ставят в термостат на 2 ч. Одновременно в термостат помещают 265 г муки того же сорта, 130 см3 воды, в которой растворено 4 г поваренной соли, и стандартную форму (см. рис. 38), смазанную растительным маслом. Через 2 ч смесь дрожжей, воды и муки переводят в дежу лабораторной тестомесильной машины (или большую фарфоровую чашку), смывая остатки смеси 130 см3 солевого раствора, после чего засыпают 265 г согретой муки. Тесто замешивают в течение 5 мин с момента внесения дрожжей, затем переносят его в форму и далее поступают так же, как при определении подъемной силы прессованных дрожжей.
13.5. СУЛЬФИТОСТОЙКОСТЬ ВИННЫХ ДРОЖЖЕЙ
Способ 1. Для сравнительного изучения сульфитостойкости различных культур дрожжей их нужно подвергнуть действию одинаковой дозы свободной SO2. Сульфитостойкие расы можно отбирать по скорости забраживания виноградного сусла, содержащего 100 мг/дм3 свободной SO2 в момент внесения в сусло разводок изучаемых культур.
Вначале проводят пробную сульфитацию сусла разными дозами SO2 и выбирают такую, при которой через час после внесения SO2 в сусло в нем будет содержаться около 100 мг/дм3 свободной сернистой кислоты. Сразу после сульфитации содержание ее быстро уменьшается, так как она вступает в соединение с составными частями сусла (са-харами, альдегидами и др.), а спустя 1–2 ч ее количество уже заметно не меняется. Затем сульфитируют сусло выбранной дозой SO2 в склянке вместимостью 2000 см3 с нижним тубусом, склянку закрывают, сусло перемешивают и оставляют на час.
За это время в стерильные небольшого объема склянки, размеченные до стерилизации по 20 см3, вносят по 0,2 см3 двухсуточных разводок исследуемых рас дрожжей. Каждую культуру вносят в три склянки, т. е. опыты ставят в трех повторениях.
Через час после сульфитации сусло из 2-литровой склянки разливают через нижний тубус по 20 см3 в склянки быстро, но осторожно, чтобы оно не разбрызгивалось. Для предотвращения улетучивания SO2 склянки закрывают резиновыми пробками, обработанными спиртом, и затем ставят в термостат при температуре 27°С. При такой постановке опыта все культуры дрожжей подвергаются действию одинаковой дозы свободной SO2. Ежедневно в течение 10 дней опытные склянки просматривают и отбирают сульфитостойкие расы дрожжей по скорости размножения и забраживания сусла.
Способ 2. Быстрее и проще можно определять сульфитостойкость по скорости размножения штаммов дрожжей на сульфитированном виноградном сусло-агаре в чашках Петри. Сусло перед розливом в чашки Петри смешивают с равным количеством 3%-ного водного агара. В связи с невозможностью определять содержание сернистой кислоты в сусло-агаре для подбора дозы сульфитации виноградное сусло в нескольких контрольных порциях смешивают с таким же количеством водопроводной воды (вместо 3%-ного водного агара). Разбавленное сусло в склянках сульфитируют несколькими дозами крепкого водного раствора сернистой кислоты для того, чтобы можно было выбрать дозу сульфитации, при которой через час после внесения SO2 в сусле, а также в сусло-агаре будет содержаться около 100 мг/дм3 свободной сернистой кислоты. Содержание свободной сернистой кислоты определяют йодометрическим методом.
Штаммы исследуемых дрожжей предварительно выращивают в течение 2 суток в виноградном сусле при температуре 27°С, а затем уколом иглы наносят на поверхность сульфитированного сусло-агара в количестве 25 штаммов на чашку. Кончик иглы для этого погружают в разводки исследуемых культур примерно на 1 см. Чашки Петри с посевами помещают в термостат и выдерживают при температуре 27°С. Ежедневно в течение недели просматривают чашки Петри и отбирают сульфитостойкие штаммы, колонии которых вырастают раньше.
Первичный отбор проводится при содержании свободной сернистой кислоты 100 мг/дм3, а затем наиболее сульфитостойкие штаммы отбирают при содержании ее 150 мг/дм3.
Для получения более объективной информации следует использовать микроскопические методы оценки состояния исследуемых культур дрожжей.
13.6. ТЕХНОЛОГИЧЕСКАЯ УСТОЙЧИВОСТЬ КУЛЬТУРЫ. АВТОЛИЗНОЕ ЧИСЛО***
Для оценки степени устойчивости дрожжевой культуры к неблагоприятным факторам питательной среды может использоваться тест для определения технологической стойкости дрожжей – автолизное число.
Тест основан на определении количественной разницы в среде аминно-аммонийного азота между двумя измерениями с учетом прироста клеточной массы. Ввиду того, что стадии разбраживания и активного брожения (лаг-фаза Þ фаза логарифмического роста) сопровождаются активным приростом пока еще здоровой клеточной массы, а значит, активным потреблением доступного азота, измерения следует начинать по завершении стадии активного брожения – при переходе культуры в стационарную фазу Þ фазу затухания Þ гибели. Интервал между измерениями может быть выбран произвольно в течение всего периода брожения.
Суть предлагаемого теста видна из формулы
где А – автолизное число; N1 – количество усвояемого азота начальное; N2 – количество усвояемого азота конечное; K1 – концентрация дрожжей начальная; К2 – концентрация дрожжей конечная.
Таким образом, автолизное число выражает увеличение/уменьшение количества аминно-аммонийного азота в среде на 10 млн/см3 клеток дрожжей между двумя измерениями.
Полученные результаты могут регистрироваться на графике, отображающем время брожения и величину автолизного числа.
Избыточное увеличение аминно-аммонийного азота, или высокий показатель автолизного числа, может свидетельствовать о высокой интенсивности автолизных процессов и, как следствие, слабости или дефектности очередной генерации или культуры вообще.
Вместе с тем, чем больше автолизное число, тем больше биомасса подвержена воздействию неблагоприятных факторов среды с точки зрения ее физико-химических параметров.
Тест и более информативен, и более объективен, нежели простой подсчет процентного соотношения живых и мертвых клеток, который на сегодняшний день в производственных лабораториях является единственным критерием оценки жизнеспособности культуры. Данный анализ позволяет не только констатировать факт гибели клетки, но и оценить степень ее деструктивных изменений, учесть весь массив факторов, воздействующих на дрожжевую клеточную массу в процессе брожения, с учетом технологических особенностей конкретного предприятия.
Изменяя те или иные параметры брожения по показателю автолизного числа, можно определить жизнеспособность клеточной популяции в конкретных физико-химических условиях среды.
13.6.1. ФОРМОЛЬНОЕ ЧИСЛО
Усвояемый азот в среде определяется формольным титрованием. Сущность метода заключается в том, что формалин реагирует с аминогруппами большинства аминокислот и вытесняет серную кислоту из аммонийных соединений. Образующиеся метиленаминогруппы и серная кислота оттитровываются щелочью.
Способ 1. 10 см3 среды через бумажный фильтр отфильтровывают от дробины и дрожжей, разбавляют дистиллированной водой до 100 см3 и титруют 0,1 Н раствором NaOH с фенолфталеином до слаборозового окрашивания. Затем туда же вносят 5,0 см3 нейтрального формалина и вторично титруют тем же раствором NaOH до слаборозового окрашивания.
Количество миллилитров 0,1 Н NаОН, пошедшее на вторичное титрование, называют формольным числом исследуемой жидкости, оно является величиной относительной.
Чтобы выразить формольное число в абсолютных величинах растворенного в среде аминного и аммонийного азота, нужно формольное число умножить на коэффициент 0,0014, т. е. 1 см3 1 Н раствора NаОН соответствует 0,014 г азота в 1000 см3 среды.
Способ 2. В стакане взвешивают 25±0,01 г питательной среды, и навеску теплой дистиллированной водой, освобожденной кипячением от СO2, переводят в мерную колбу на 100 см3.
Раствор охлаждают до 20°С, доводят водой до метки и перемешивают.
В химический стакан отбирают пипеткой 20 см3 полученного раствора и титруют 0,1 Н раствором щелочи до рН = 7,0. Затем сюда же приливают 5 см3 формольной смеси и продолжают титрование до рН = 9,1.
Для контрольного титрования в химический стакан отмеривают 20 см3 дистиллированной воды и 5 см3 формольной смеси и также титруют до рН = 9,1.
Содержание аминно-аммонийного азота рассчитывают по формуле
N = 0,0014 · (а — б) ·100 : Н,
где N – усвояемый азот (%); a – объем 0,1 Н щелочи, пошедшей на титрование 20 см3 раствора питательной среды (см3); б – то же, на титрование контрольной пробы (см3);
Н – навеска питательной среды в 20 см3 раствора (г).
Например, N = 0,0014 · (11,2 — 0,2) · 100 : 5 = 0,31%
Формольная смесь.
Формалин, х. ч……………………………….. 50,0 см3
Фенолфталеин, 1%………………………….. 1,0 см3
Оттитровать 0,1 Н NаОН до слаборозового окрашивания.
Пригодна в течение 2–3 дней.