Сегодня поставить прививку от COVID-19 можно с использованием нескольких препаратов. Какие виды вакцин от ковида применяются в нашей стране? Чем они отличаются друг от друга? Какие прививки ставят в других странах? Давайте разберемся в этих вопросах.
Российские типы вакцин от ковида
В нашей стране в настоящий момент используются исключительно отечественные препараты.
Они разделяются на несколько групп:
- Векторные. Эти вакцины являются генно-инженерными. Они созданы с использованием гена одного из белков вируса. К векторным препаратам относятся «Спутник V» и «Спутник Лайт». Они обеспечивают эффективную выработку антител и клеточного иммунитета
- Пептидные. Эти вакцины созданы на основе готовых очищенных белков вируса. Пептидным препаратом является «ЭпиВакКорона»
- Цельновирионные (цельновирусные). Эти вакцины созданы на базе инактивированных (убитых) или ослабленных частиц вируса. Цельновирионным препаратом является «КовиВак»
Рассмотрим все вакцины от коронавируса более внимательно, определим их виды и отличия.
«Спутник V» (от Исследовательского центра имени Н. Ф. Гамалеи)
Препарат создан на основе аденовируса (вируса, вызывающего ОРВИ) человека. Для разработки вакцины вирус лишили гена размножения. Благодаря этому он стал так называемым вектором (транспортным средством для доставки груза в клетки организма). В качестве груза в данном конкретном случае выступает генетический материал заболевания, против которого и работает препарат. Поступая в клетку, груз стимулирует выработку антител.
Важно! После введения первой дозы препарата организм человека от заражения еще не защищен. Это обусловлено тем, что антитела вырабатываются постепенно. Максимальный их уровень обеспечивается примерно через 2–3 недели после постановки второй прививки.
- Общая эффективность вакцины «Спутник V» составляет 91,6%
- Защита от тяжелого течения заболевания – 100%
Иммунитет после вакцинации сохраняется примерно 2 года. При этом важно понимать, что антитела в крови присутствуют определенное количество времени, которое во многом зависит от индивидуальных особенностей пациента. В настоящий момент говорят о том, что хватает их примерно на год. При этом клеточный иммунитет сохраняется. Он защищает организм и после исчезновения антител.
«Спутник Лайт» (однокомпонентный вариант вакцины «Спутник V»)
Этот препарат отличается от исходного тем, что достаточно введения одной его дозы.
«ЭпиВакКорона» (от Центра «Вектор»)
Данная вакцина разработана на основе искусственно созданных фрагментов белков вируса. Благодаря этому она дает минимальное количество побочных эффектов. К основным относят возможную болезненность в месте инъекции и незначительное повышение температуры тела на короткое время. При этом и эффективность препарата является более низкой, чем у вакцины «Спутник V». Для повышения данного показателя проводится двукратная вакцинация с интервалом в 2–3 недели. На формирование иммунитета уходит около 30 дней. Ревакцинация по предварительным оценкам требуется примерно через 6–9 месяцев.
Разработчики уверяют, что препарат может обеспечить защиту организма от различных штаммов коронавируса. Но существует и другое мнение. Некоторые специалисты утверждают, что вакцина уязвима при мутациях вируса.
- Общая эффективность «ЭпиВакКороны» в настоящий момент не определена
- Защита от тяжелого течения заболевания – 100%
«КовиВак» (от Центра М. П. Чумакова)
Для производства вакцины использован вирус COVID-19. Он выращивается специально, а затем убивается химическим путем. Недостатком препарата является то, что он не может проникать в клетки и формировать там клеточный иммунитет. Поэтому на страже здоровья человека, привитого вакциной «КовиВак», стоят только антитела. При этом препарат демонстрирует эффективность не только в отношении исходного вируса, но и его штаммов. Вводится вакцина двукратно, с интервалом в 2 недели. Иммунитет формируется на 28 день.
- Общая эффективность вакцины «КовиВак» составляет 90% (по предварительным данным, результатов клинических испытаний еще нет)
- Защита от тяжелого течения заболевания – 100%
Иностранные виды вакцин от коронавируса
мРНК-препараты
К ним относят: Pfizer/BioNTech и Moderna. Вирусные белки для производства препаратов синтезируются непосредственно в организме человека. Матричная РНК представляет собой своеобразную инструкцию. Прочитав ее, клетка начинает самостоятельно вырабатывать закодированный белок (фрагмент коронавируса). Препараты Pfizer/BioNTech и Moderna сегодня применяются для вакцинации в Великобритании, Израиле, странах Евросоюза, на Украине, в США и в других государствах. Прививки демонстрируют хорошую защиту от тяжелого течения заболевания. Это обусловлено тем, что вакцины проникают вглубь клеток, что имитирует инфицирование и приводит к формированию полноценного иммунитета. Недостатком препаратов является их недостаточная изученность.
Векторные препараты
Таким средством является вакцина AstraZeneca. Изготовлена она по принципу препарата «Спутник V». В качестве вектора в AstraZeneca выступает модифицированный вирус шимпанзе. Эффективность этой вакцины составляет 79%. При этом препарат на 100% защищает от тяжелого течения вирусной инфекции. Он используется в странах Евросоюза.
Цельновирусные препараты
К ним относят Sinopharm и Sinovac.
Основными крупными поставщиками вакцин стали биофармацевтические компании из Китая. Они разработали препараты по принципу российского препарата «КовиВак». Вакцинация Sinopharm и Sinovac проводится не только в КНР, но и в Турции, ОАЭ, Чили, Аргентине и ряде других стран. Во время третьей фазы исследований определена общая эффективность препаратов, которая варьируется от 50% до 84%. При этом от тяжелого течения заболевания средства защищают на 100%.
Сравнение российских препаратов
Для правильного выбора прививки от коронавируса нужно сравнить между собой представленные препараты. Мы провели такое сравнение и оформили его в виде таблицы для вашего удобства.
| «Спутник V» | «Спутник Лайт» | «КовиВак» | «ЭпиВакКорона» | |
|---|---|---|---|---|
| Срок формирования иммунитета (в днях) | 42 | 28 | Исследуется | 35-40 |
| Формирование антител (в процентах от вакцинированных) | У 98% | Почти у 97% | Исследуется | Более чем у 82% |
| Эффективность | Более 91% (в том числе для пациентов старше 65 лет) | Почти 80% | На стадии исследований | В настоящий момент не установлена |
Побочные эффекты вакцин
Необходимо сразу уточнить, что все побочные эффекты легкого и умеренного типов являются вариантом нормы.
К ним относят:
- повышение температуры тела до 38 градусов
- другие симптомы стандартной простуды
- боль в зоне введения препарата
- умеренную головную боль
- дискомфорт в мышцах и суставах
В некоторых случаях также возможно развитие диареи.
После введения препарата пациент на 20–30 минут остается в медицинском учреждении. Это необходимо по причине риска развития аллергической реакции.
Преимущества обращения в МЕДСИ
- Опытные специалисты. Вакцинация проводится средним медицинским персоналом (медицинскими сестрами) с необходимыми знаниями и навыками
- Возможности для введения двух препаратов. Иммунизация может проводиться проверенными вакцинами «Спутник V» и «Спутник Лайт», подтвердившими свою эффективность в ходе испытаний
- Возможности для диагностики. Перед постановкой прививок можно пройти необходимые обследования, осмотры врачей и проконсультироваться с ними
- Программы подготовки к иммунизации
- Консультация врача. Наш специалист расскажет, какие есть прививки от ковида, объяснит различия всех разновидностей
- Комфортные условия проведения процедуры. Вакцинация проводится без очередей и длительного ожидания, в удобный день. Для прохождения процедуры каждый пациент может выбрать ближайшую к нему клинику
Чтобы уточнить, какие виды вакцин против ковида мы используем, или записаться на прививку, достаточно позвонить по номеру +7 (495) 7-800-500. Наш специалист ответит на все вопросы. Также запись возможна через приложение SmartMed.
Появление векторной вакцины Sputnik V внесло некоторую сумятицу в типичное представление о вакцинах как о некой дозе ослабленных или дезактивированных патогенов, внедренных для тренировки иммунитета. Еще больше вопросов породил тот факт, что именно векторная вакцина появилась первой, а более простые и привычные варианты подоспели позднее. Ну и вопрос на засыпку: в чем проблема налаживания выпуска всех этих вакцин и почему в массовом доступе они только начинают появляться?
Для получения некоторых вакцин от гриппа надо заразить эмбрион в яйце вирусом и дать вирусу размножиться (фото: CDC)
Ниже — расшифровка лекции специалиста по промышленным биотехнологиям, которая прошла при поддержке ярославской Точки при ЯрГУ. В ней — подробно о типах вакцин, механизмах их работы и способах массового производства.
Но сначала я представлю спикера: это Антонина Обласова — биолог, специалист по промышленным биотехнологиям, соучредитель и директор АНО «Коллективный иммунитет» (vaccina.info), а также автор блога «Антонина О. Вакцинах». Далее — переработанный текстовый вариант самой видеолекции.
Типы вакцин
Речь пойдет как о противовирусных вакцинах, так и об антибактериальных. Для начала рассмотрим логику работы действующего вещества вакцины, которое при введении в организм будет вызывать иммунный ответ. Проведем необычную параллель: представим на минуту, что дикая инфекция — это дикий зверь, например волк. Мы стараемся от него всячески защититься и ищем способы избежать последствий от встречи с ним.
Вакцинация — это метод, позволяющий снизить риски от этой встречи. Вакцины не все одинаковы по своей структуре и используют разные подходы.
Первый подход: обезвредить токсин, производимый этой дикой инфекцией. Сравнивая с волком, можно себе представить токсин в виде слюны животного. Мы можем ее собрать, деактивировать и вводить в организм, вырабатывая тем самым защиту — иммунитет.
Второй: ослабить волка, саму инфекцию, натренировав иммунитет на едва живом «звере».
Третий: взять похожий патоген (микроорганизм, вызывающий болезнь у другого существа) и ослабить его. Именно этот метод использовали в процессе разработки вакцины против черной оспы или туберкулеза.
Четвертый: убить волка, другими словами — инактивировать патоген. Так делают вакцины от клещевого энцефалита, цельновирионные гриппозные вакцины и некоторые другие. Кроме того, из массы убитых патогенов можно выделить отдельные части — антигены — и вводить их в организм в качестве действующего вещества вакцины. Так поступают при создании вакцин от пневмококковой и менингококковой инфекций, которые содержат лишь отдельный фрагмент возбудителя заболевания.
Еще один вариант — искусственно воссоздать отдельные фрагменты патогена при помощи генно-инженерных технологий. По этому принципу устроены вакцины от гепатита B, вируса папилломы человека и некоторые другие редкие или ветеринарные вакцины.
Существуют и другие подходы, например ДНК- и РНК-вакцины, векторные вакцины, о которых чуть ниже.
Всемирная организация здравоохранения предлагает нам разделить все вакцины на две группы: живые и неживые. В одну группу входят живые ослабленные вакцины, а в группе неживых выделены инактивированные, субъединичные (состоящие из отдельных фрагментов) и анатоксины (обезвреженные яды патогенов). В эту классификацию укладывается большинство существующих сегодня вакцин (но не все).
Среди прочих вариантов — модифицированная бактерия с геном антигенов вируса. Когда пандемия еще только начиналась, возможно, вы слышали в новостях о том, что одна из создаваемых против COVID-19 вакцин будет в виде йогурта, — речь шла как раз о такой технологии. Также многие слышали такие выражения, как «ДНК-вакцины», «РНК-вакцины», «векторные вакцины». Все это — современные технологии, которые пока редко используют в производстве вакцин.
Векторные вакцины
Векторная технология — это палочка-выручалочка.
Она позволяет создать вакцину быстро — гораздо быстрее, чем все другие существующие вирусные технологии.
Дело в том, что производить и ослаблять до нужной степени новый малоизученный вирус — это очень долгий процесс. Гораздо проще сделать подмену.
Вектор — это другой хорошо исследованный вирус, безопасный для человека. Система этого вируса изучена до мелочей: мы знаем, в каких клетках эти вирусы могут расти, в каком количестве, как размножить их в пробирке и как наладить производство больших объемов.
В данный вирус-вектор мы вносим изменения — берем кусочек ДНК или РНК патогена, который кодирует иммуногенную часть на его поверхности, и пересаживаем в генетический материал вектора.
У нас получается химера — безопасный для человека вирус, для которого организм производит антитела и формирует клеточный иммунитет против антигенов дикой инфекции. При этом сама дикая инфекция к нам в организм не попадает.
В современных вакцинах, которые сегодня разрабатывают для борьбы с коронавирусом, эти вирусные векторы не реплицируются, то есть не размножаются в организме, поскольку у них отключен соответствующий ген.
Он может размножаться в клеточной культуре, но непосредственно в организме человека — нет. Если, условно, в организм попали десять копий вируса, десять копий и остались.
Более раннее применение этой технологии нашлось в генной терапии. С ее помощью производят очень дорогие лекарства для детей со спинальной мышечной атрофией.
Например, такой препарат, как золгенсма, делают с использованием векторной технологии. Только используют не аденовирус, а аденоассоциированный вирус, в который встроили ДНК, необходимую для синтеза того белка, которого недостает в организме больных. Внедряя этот вектор в организм ребенка, мы восполняем дефицит белка и вылечиваем его от этой болезни.
Отличие вирусов от бактерий
Перед тем как перейти к рассказу о производстве вакцин, вспомним, что есть два вида патогенов, вызывающих вакциноуправляемые инфекции: вирусы и бактерии. Бактерии — это самые настоящие живые организмы, они самостоятельно питаются и размножаются. Вирусы — облигатные паразиты, это значит, что они не способны размножаться вне клетки. Без клетки (бактериальной, грибной, растительной или животной) вирус не может существовать — это просто пыль.
В этом смысле вирус похож на программу, записанную на флешке: пока вы не подключите носитель к компьютеру, ничего не произойдет. Если же флешку подключить, программа может быть скопирована и запущена.
Чтобы получить большое число бактерий, необходима питательная среда. Например, мы можем посеять бактерии на чашку Петри с питательным агаром. А можем оставить хлеб на столе: на нем размножатся бактерии из спор, витающих в воздухе.
Вирусу недостаточно одной питательной среды. Вирусу нужен хозяин: живая клетка, в которую он внедрится и чей обмен веществ будет использовать, чтобы многократного скопировать самого себя. Это принципиальное различие между вирусами и бактериями, которое определяет принципы создания антибактериальных и вирусных вакцин.
Ну а само классическое производство вакцин — это получение нужного нам патогена, который затем будет ослаблен, убит или разобран на части.
Производство антибактериальных вакцин
Итак, чтобы сделать вакцину для профилактики бактериальных инфекций, надо в достаточном количестве получить патоген, то есть большое количество клеток возбудителя заболевания.
Бактериальную массу выращивают в жидкой питательной среде. Чтобы получить посевной материал, используют колбу, которую ставят в шейкер и постоянно трясут, чтобы обогащать питательную среду кислородом. Затем полученную культуру выращивают на оборудовании, которое называется ферментер (от англ. fermentation).
Ферментеры отличаются по размеру: резервуар, в котором размножаются микроорганизмы, может быть от одного до десятков тысяч литров. В основном эти аппараты изготавливают из стекла и нержавеющей стали — к таким материалам бактерии нечувствительны, поэтому прекрасно растут и размножаются.
Ферментер — сложное оборудование: все процессы проходят в условиях строгой стерильности, по трубкам в автоматическом режиме поступают глюкоза, минеральные вещества, витамины и другие добавки. Стерильный воздух тоже подают автоматически. Внутри емкости поддерживается определенная температура, давление и уровень кислорода, питательная среда постоянно перемешивается.
Чтобы контролировать состав питательной среды, из ферментера условно каждый час отбирают пробы и анализируют количество бактерий и питательных веществ. В зависимости от результата корректируют автоматические программы. В маленьких ферментерах это делают стерильно через шприц, а в больших промышленных может быть встроена целая автоматическая аналитическая лаборатория.
Аналогичным образом делают рекомбинантные вакцины. Например, вакцину против гепатита B создают с помощью генно-модифицированных дрожжей, которые производят поверхностный антиген гепатита B.
Если для получения вакцины выращенные бактерии нужно убить, этап инактивации запускают прямо в ферментере, чтобы не нарушать стерильность. Это можно сделать разными способами: например поднять температуру среды. Также можно добавить формалин или изменить показатель pH, добавив щелочь или, наоборот, кислоту, — от резкой смены кислотности среды микроорганизмы могут сразу умереть.
Следующий шаг — очистка бактерий от остатков питательной среды, в которой они жили. После него идет добавка стабилизаторов и других веществ, о которых ниже. И — антибактериальная вакцина готова.
Производство вирусных вакцин
Для производства вирусных вакцин нам потребуется субстрат — клетки других организмов. Это могут быть клетки млекопитающих, в том числе человека — обычно предоставлены бессмертными иммортализованными линиями клеток. Также это могут быть клетки куриных и перепелиных эмбрионов, так производят вакцины от клещевого энцефалита, от кори и паротита — первичная не бессмертная клеточная линия.
Использовать оплодотворенные куриные яйца — одна из самых старых технологий, ее применяют только для создания вакцин от гриппа. Она не единственная, но одна из основных.
Чтобы произвести вакцину, в том числе векторную, мы должны сначала получить много-много клеток — некую «почву» или субстрат, чтобы потом заразить их вирусом.
Производство на основе выращенной клеточной массы
Для этого мы берем посевной материал в маленькой пробирке — замороженные клетки, поведение которых хорошо изучено. Клетки размораживаем и помещаем в питательную среду в маленьком объеме. Помещать клетки сразу в большой объем нельзя. Из-за маленькой плотности они просто погибнут (в этом случае говорят, что клетки погибли от одиночества). Поэтому их разводят в маленьком объеме и при достижении определенной плотности помещают в емкости большего размера.
Эту операцию повторяют несколько раз. В процессе размножения среду перемешивают. Если клетки чувствительны к механическому повреждению, для перемешивания используют специальное оборудование — волновой биореактор, в нем закрепленная на оси пробирка выполняет определенные движения. Применяют и биореакторы вертикального перемешивания, максимальный объем которых доходит до двух тысяч литров.
Устройство биореакторов для противовирусных вакцин отличается от биореакторов для производства антибактериальных вакцин. В контейнер, управляемый отдельно стоящим модулем, устанавливают специальный мешок — так называемую одноразовую систему (SUS — single use system), где будет происходить выращивание клеточной массы.
Это долгий процесс, который занимает три — четыре недели. Вдобавок клетки млекопитающих очень чувствительны к бактериальному и постороннему вирусному заражению, поэтому очень важно соблюдать полную стерильность процесса.
На входе в мешок установлен стерилизующий фильтр, не пропускающий бактерии, а также ряд противовирусных фильтров. Кроме того, в устройстве предусмотрена стерильная подача воздуха и стерильные соединения для перекачки содержимого на следующие этапы производства.
Производство на первичных клеточных линиях
Другой вариант — размножение вируса на первичных клеточных линиях, когда клетки не выращивают в реакторе, а получают из готового биоматериала. На изображении ниже вы можете видеть схему производства вирусной вакцины от клещевого энцефалита.
Оплодотворенные куриные эмбрионы развиваются в инкубаторе, после чего их достают и фактически перемалывают в мясорубке, получая первичную культуру клеток. Каждый раз, перед каждым производством, ее делают заново. Если бессмертные клетки мы берем из производственного стокового банка, то здесь каждый раз создаем новую клеточную культуру.
Эту клеточную культуру заражают посевным материалом вируса. Дальше вирус размножается в клетках, пока не достигает необходимой плотности. То, что получилось, охлаждают и очищают от всего лишнего, то есть от осадков клеточной культуры, на которой производились вирусы, и затем уже формируется вакцина — финальный продукт. Подробнее обо всем этом чуть ниже.
Производство «на яйцах»
В производстве вакцин «на яйцах» каждый эмбрион, то есть оплодотворенное яйцо, заражают, а затем выдерживают определенное время в специальном инкубаторе.
Инкубатор необходим для того, чтобы и эмбрион сохранял жизнеспособность, и вирус размножался. Грубо говоря, из каждого яйца получают дозу вакцины. Разумеется, это не куриные яйца из супермаркета, а сертифицированные яйца, которые специально отбирают для завода по производству вакцины от гриппа.
Очистка
После того как мы наработали действующее вещество вакцины (например, при помощи клеточной структуры млекопитающих, либо насекомых, либо дрожжей, либо бактерий), мы приступаем к процессу очистки. Это также очень длительный этап.
На схеме показан процесс очистки при производстве пневмококковой вакцины. Убили вирус, затем поместили в центрифугу, затем провели этап осветления и стерилизующую фильтрацию: удалили все компоненты больше 0,2 мкм. После этого проводим диафильтрацию — это фильтрация в ламинарном потоке, когда давление прикладывают не перпендикулярно, а параллельно мембране, что позволяет заменить буфер и полностью удалить остатки среды.
Далее следует несколько этапов очистки, многие из них повторяются. В итоге мы получаем полностью очищенный от всего лишнего действующий компонент вакцины. В данном случае это полисахариды одного конкретного штамма, который мы потом смешаем с полисахаридами других штаммов, внесем дополнительные компоненты для стабильности и эффективности (о них ниже) и получим конечный вариант вакцины.
Состав вакцин
Кроме действующего вещества в вакцину входят вспомогательные компоненты. Если вакцина жидкая, то это вода. Вместе с водой в состав могут входить адъюванты, стабилизаторы и консерванты.
Стабилизаторы и эмульгаторы
Антигены — это сложные молекулы, очень чувствительные к изменениям рH и температуры. Чтобы вакцина оставалась эффективной при любых условиях, используют стабилизаторы. Это могут быть обычные соли калия, магния, натрия — буфер для стабилизации pH. Все эти компоненты входят в состав клеток лимфы человека. В жидкие вакцины могут входить щелочи и кислоты. Обычно это следовые концентрации для стабильности буферного раствора.
Эмульгаторы необходимы для того, чтобы сохранить гомогенность раствора. Чаще всего используют Полисорбат 80, ТРИС или октосинол-10 — это относительно новые в фармацевтике вещества. Существуют всевозможные безумные мифы о вреде и токсичности стабилизаторов — все они лишены оснований. В таких низких концентрациях, при которых эти компоненты обеспечивают гомогенность раствора, они вреда не несут.
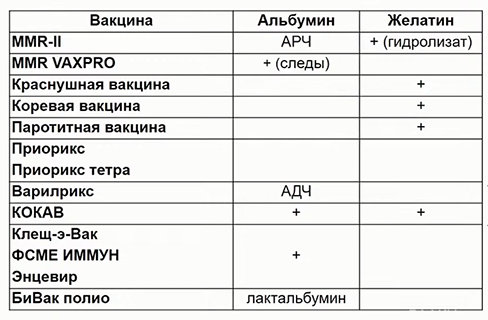
В лиофилизированных, то есть, высушенных, вакцинах используют другие стабилизаторы. Например, сахара (лактозу, сахарозу, мальтозу) и многоатомные спирты (сорбитол, маннит). Популярный стабилизатор — желатин, частично или высоко гидролизованный коллаген животного происхождения. Часто используют альбумин: человеческий донорский, рекомбинантный или гидролизат лактальбумина (белок из молочной сыворотки).
Если у прививаемого нет аллергии на эти компоненты, то неважно, какой именно стабилизатор использовали, — вакцина будет одинаково эффективна. Если у человека есть тяжелая аллергическая реакция на один из компонентов, например на желатин, лактозу или альбумин, на это обязательно нужно обратить внимание — состав вакцины всегда указывают в инструкции.
Зачем нам знать про адъюванты и конъюгаты
Адъюванты и конъюгаты — это вещества, усиливающие эффективность вакцины. Некоторые маленькие белковые молекулы могут быть недостаточно заметными для иммунной системы, поэтому к ним добавляют, например, соединения алюминия, гидроксид или фосфат.
В вакцинах от гриппа, произведенных в РФ, используются полиоксидоний и совидон. В ветеринарии активно используют масляные адъюванты (за пределами РФ их можно встретить в вакцинах для человека).
По сути, адъювант — это адсорбент, на поверхность которого налипает антиген. Мы получаем укрупнение частиц, повышаем заметность действующего вещества и, соответственно, большую эффективность.
Алюминий используют в виде очень-очень мелкого песка, на поверхности которого адсорбируют антигены вакцины. Он «переваривается» и выходит из организма точно так же, как и тот алюминий, который попадает к нам в организм вместе с пищей и водой уже в виде растворимых соединений.
То же самое происходит и с адъювантами другого происхождения: они постепенно метаболизируются. Тут стоит вспомнить про еще один антипрививочный миф о вакцинах, о том, что в них якобы находятся тяжелые металлы. Алюминий — металл легкий, так что и это утверждение не имеет оснований.
Еще один способ усилить реакцию на вакцину — конъюгировать маленький белок либо маленький полисахарид с другим белком. Например, у маленьких детей иммунная система незрелая и вообще не распознает полисахариды. Значит, необходима адаптация. Для этого полисахарид из сахарной капсулы бактерии (ее оболочки) соединяют с белком-носителем (как правило, это дифтерийный или столбнячный анатоксин), и в таком варианте вакцина уже работает. По такому принципу устроены вакцины от пневмококковой, гемофильной и менингококковой инфекций.
Консерванты
Это вещества, которые повышают стабильность состава. В вакцине среда не очень питательная, однако и в ней могут завестись посторонние микроорганизмы. Чтобы этого не произошло, добавляют консерванты. Особенно это актуально для многодозовых флаконов.
Вид консерванта зависит от типа вакцины. С одними консервантами антигены сохраняются хорошо, с другими — нет. Какой именно консервант будет наиболее подходящим, определяют «методом научного тыка» — с помощью экспериментов, замеряя стабильность состава вакцины. Например, ртутьорганический антисептик мертиолят (тиомерсал) применяют в многодозовых флаконах с детскими вакцинами и во взрослых вакцинах от дифтерии, столбняка, гепатита В и гриппа.
Обратите внимание, что это не ртуть, а ртутьорганический антисептик, он безопасен и его используют не только для производства вакцин, но и в косметике. Найти его можно в очень ограниченном количестве современных вакцин. Одно время он был предметом споров. В 2000-х годах его со скандалом исключили из числа компонентов под давлением общественности, так как в то время данных о его безвредности было недостаточно. В 2009 году Американская академия педиатрии отозвала собственное заявление, в котором ранее рекомендовала исключить этот консервант из состава вакцин.
Другой консервант — феноксиэтанол. Его применяются в инактивированных вакцинах от полиомиелита, а также от дифтерии, столбняка и гемофильной инфекции. Что касается такого консерванта, как фенол, то это вещество используют только в вакцинах от пневмококковой инфекции, причем только полисахаридных, которые не применяют для детей.
Антибиотики тоже используют в качестве консерванта, но делают это редко. Например, в составе российской оральной полиомиелитной вакцины присутствует канамицин. Это не терапевтическая доза, но ее достаточно, чтобы сохранить стерильность препарата. Переживать относительно антибиотикорезистентности из-за трех доз, которые получит ребенок в процессе вакцинации, не стоит — они очень малы.
Следы производства
Следы производства — это не компоненты вакцины, добавляемые в процессе ее изготовления. Это то, что невозможно удалить на сто процентов, поскольку не существует таких чувствительных методов, которые могли бы показать, что мы удалили компонент полностью. К следам производства можно отнести формальдегид, используемый для инактивации некоторых бактериологических вакцин.
Очевидно, что в следах производства будет присутствовать питательная среда, включая аминокислоты, сыворотку, белок коровьего молока (БКМ, казеин — один из компонентов среды при производстве вакцины от коклюша). Следы питательного субстрата не токсичны для человека и имеют значение только в том случае, если у прививаемого есть тяжелая аллергическая реакция на один из компонентов.
Также могут присутствовать следы продуцента — белки дрожжей, следы белка куриного яйца. Обращать на это внимание стоит тоже только при наличии тяжелой аллергии.
У каждой вакцины свои компоненты и свой процесс изготовления, поэтому следы производства в каждом случае свои. Например, если для вакцины MMR-II от кори, краснухи и паротита нужен рекомбинантный альбумин человека и гидролизат желатина (вероятно, у производителя только так получилось обеспечить стабильность вакцины в течение всего срока годности) — то эти следы производства будут присутствовать. Но при этом там может не быть, скажем, консерванта (строго говоря, его там по определению быть не может, поскольку это живая вакцина и консервант может ее убить). Краснушная вакцина нашего производителя будет содержать только желатин, поскольку таким образом получилось ее стабилизировать.
Что в итоге
Главный вывод — все вакцины разные. Их производят разными способами, поэтому они имеют разный состав.
Важно понимать, почему в отдельно взятой вакцине находятся именно такие компоненты, а не другие. Следует обращать внимание на то, не несут ли составляющие вакцины угрозу в связи с тяжелой аллергической реакцией. Это единственное требование для обеспечения максимального снижения рисков вакцинации.
Любая вакцина состоит только из тех компонентов, которые обеспечивают ее безопасность и эффективность. Не стоит полагаться на мифы о том, что в состав входят какие-то неизвестные вещества. Те компоненты, которые не выполняют никакую полезную функцию, содержатся в очень малых количествах и являются остаточным следом производства.
FAQ
Чем различаются технологии создания вакцин от коронавируса?
Вакцина против коронавируса от Института Гамалеи — это векторная вакцина. В ее основе аденовирус, измененный таким образом, чтобы заставлять клетки нашего организма синтезировать антигены. Также есть вакцина «ЭпиВакКорона» от научного центра «Вектор», которая создана на основе синтезированных пептидных антигенов белков вируса SARS-CoV-2, конъюгированных с рекомбинантным белком-носителем, синтезированных в бактериальной системе и адсорбированных на алюминийсодержащем адъюванте.
Что такое «процент эффективности вакцины» и как его определяют?
Если рассказывать обо всех способах вычисления эффективности вакцины, длина поста увеличится в несколько раз. В первую очередь нас интересует эпидемиологический фактор эффективности вакцины. На этапе испытания его будут оценивать, основываясь на данных о том, как отличается среди привитых и непривитых количество заболевших, тяжело заболевших и умерших. Если вакцина будет снижать хотя бы в два раза число заболевших, вакцинация уже имеет смысл.
При этом процент эффективности вычисляют путем сопоставления числа заболевших среди привитых и непривитых. Например, 95-процентная эффективность означает, что среди непривитых заболеваемость выше в 20 раз.
Другой способ оценки вакцины — определение ее иммуногенности. В этом случае выясняют, насколько вакцина позволяет получить иммунный ответ — гуморальный либо клеточный.
Эффективна ли вакцина БЦЖ?
Если в двух словах, то ситуация следующая. Представьте себе, что существует две болезни — простой туберкулез и смертельный туберкулез. Вакцинация БЦЖ — это не панацея ото всех видов туберкулеза, а лишь защита от смертельной разновидности. Она не дает маленьким детям, которые впервые столкнулись с туберкулезом, умереть от нее. Вакцинация БЦЖ не защищает от заражения, ее эффективность в этом плане всего лишь около 17 процентов, но защита от тяжелых форм туберкулеза и от летального исхода высока.
Какие обследования нужно проходить до вакцинации?
Единственное обследование, которое регламентировано для всех перед вакцинацией, — осмотр врачом. Врач обязан, кроме оценки общего состояния, выяснить, есть ли у вас противопоказания к отдельным компонентам вакцины. Еще врач может поинтересоваться, нет ли у вас тяжелого иммунодефицита — в этом случае вам нельзя будет использовать живые вакцины, зато другие вакцины будут эффективны. Если вы находитесь в стадии обострения любой инфекции или хронического заболевания, прививку стоит отложить до момента ремиссии, чтобы побочные эффекты этой болезни не были ложно истолкованы как реакция на вакцинацию. Ну и еще некоторые вакцины имеют ограничение по возрасту.
В любом разговоре о вакцинах присутствуют доктор Дженнер и оспа. В конце XVIII века Эдвард Дженнер предложил способ защититься от натуральной оспы — с помощью коровьей оспы. Он сумел связать воедино несколько общеизвестных фактов: во-первых, переболевшие оспой повторно ей не болели, во-вторых, точно так же не болели натуральной оспой те, кто перенёс коровью оспу. И для коров, и для человека коровья оспа неопасна; у человека после неё могут остаться разве что лёгкие следы на руках. В-третьих, из исторических документов Дженнер знал, что самые разные народы практиковали самодеятельные прививки от оспы. Для этого у больного оспой брали гной и каким-либо образом вводили его здоровому человеку: вкладывали ткань или ватку с гноем в нос или, например, втирали в кожу. После такой прививки некоторые получали полноценную оспу и умирали, но у многих болезнь протекала в лёгкой форме, после чего они уже никогда оспой не болели.
Первый способ — инактивировать вирус, чтобы он не мог размножаться. Например, коронавирус можно обработать бета-пропиолактоном, который сильно повреждает геномную РНК вируса — такой метод использовали при создании вакцины «КовиВак» в Центре исследований и разработки иммунобиологических препаратов им. М. П. Чумакова РАН. Второй способ — взять вирусные белки и подробно изучить, какие участки белковых молекул сильнее всего стимулируют иммунную реакцию. Эти участки в виде отдельных коротких пептидов можно синтезировать химически. По такой схеме была сделана вакцина «ЭпиВакКорона» в Центре виру-
сологии и биотехнологии «Вектор». Третий способ — использовать те же вирусные белки, но вакцину сделать не на них, а на ДНК,
которая их кодирует. Чтобы ДНК легко проникала в клетку, её вставляют в ДНК вирусного вектора — транспортного вируса, модифицированного так, что он сам не может размножаться. Часто таким транспортным вирусом становится простудный аденовирус: в его ДНК вставляют ДНК вакцинного белка и аденовирусный вектор отправляется в клетку. Этот механизм реализован в вакцине «Спутник V» Центра эпидемиологии и микробиологии им. Н. Ф. Гамалеи. Четвёртый способ — сделать на ДНК вакцинного белка много копий РНК и упаковать их в липосомные частицы: они помогут РНК проникнуть в клетку. На этом принципе изготовлены вакцины Pfizer–BioNTech и Moderna.
‹
›
Мысль Дженнера была в том, что от коровьей оспы заведомо никто не умрёт, зато получит защиту от натуральной оспы. То есть нужно использовать лёгкую форму болезни, чтобы защититься от тяжёлой формы. В этом суть любой вакцины — сымитировать болезнь. Звучит страшновато, но речь именно об имитации болезни. Организм должен запомнить болезнь, не болея. Запомнив её, он пресечёт её в зародыше, когда заражение произойдёт по-настоящему.
Что значит «организм должен запомнить болезнь»? Это значит, что её должен запомнить иммунитет. А что это значит для иммунитета? Он запоминает не симптомы, не повышенную температуру и не головную боль — иммунитет запоминает возбудителя. Представим, что в организм проник опасный вирус. Когда инфекция только появляется в организме, иммунная система запускает неспецифическую программу защиты — систему врождённого иммунитета. Он борется не с конкретной бактерией или вирусом, а вообще против неизвестного патогена, против обобщённой бактерии или обобщённого вируса. Плюс врождённого иммунитета в том, что он срабатывает очень быстро. А минус в том, что неспецифическая защита не очень эффективна и не слишком безопасна для наших собственных тканей и органов. Один только неспецифический врождённый иммунитет будет избавляться от инфекции долго, и стоить это будет дорого, в смысле сопутствующего вреда.
К счастью, у нас есть ещё адаптивный, или приобретённый, иммунитет, который в какой-то момент присоединяется к врождённому. Собственно, врождённый помогает включиться адаптивному. Некоторые клетки врождённого иммунитета, воюя с вирусом, подбирают вирусные белки и показывают их клеткам адаптивного иммунитета — В- и Т-лимфоцитам. У лимфоцитов к тому времени появляются ещё и собственные сведения, что в организме завёлся кто-то чужой и неприятный. Сопоставляя разную информацию, лимфоциты «приходят к выводу», что пора действовать. Но действуют они уже не против вируса вообще, а против конкретного вируса, который проник в организм сейчас. Лимфоциты настраивают себя против всего, что несёт на себе опознавательные признаки вируса. Иммунитет атакует сами вирусные частицы, и отдельные их фрагменты, и заражённые вирусом клетки. При этом часть В- и Т-лимфоцитов запоминает, с кем она воевала. И если спустя какое-то время тот же вирус появится снова, адаптивный иммунитет быстро всё вспомнит и сразу начнёт бороться именно с конкретным вирусом. Адаптивный иммунитет, благодаря умению воевать с конкретным патогеном, действует эффективнее врождённого, и поэтому чем быстрее он включится, тем меньше у инфекции шансов навредить. Его можно сравнить с полицейской собакой, натасканной на определённый запах: хорошо выученный пёс мгновенно найдёт след и быстро поймает преступника.
Вакцина именно этим и занимается — она натаскивает иммунитет на конкретный «запах», заставляет выучить, как выглядит тот или иной возбудитель: вирус гриппа, коронавирус, туберкулёзная бактерия и т. д. Как вакцина это делает? Или, если говорить точнее, из чего вакцину делают?
Вакцины живые и неживые
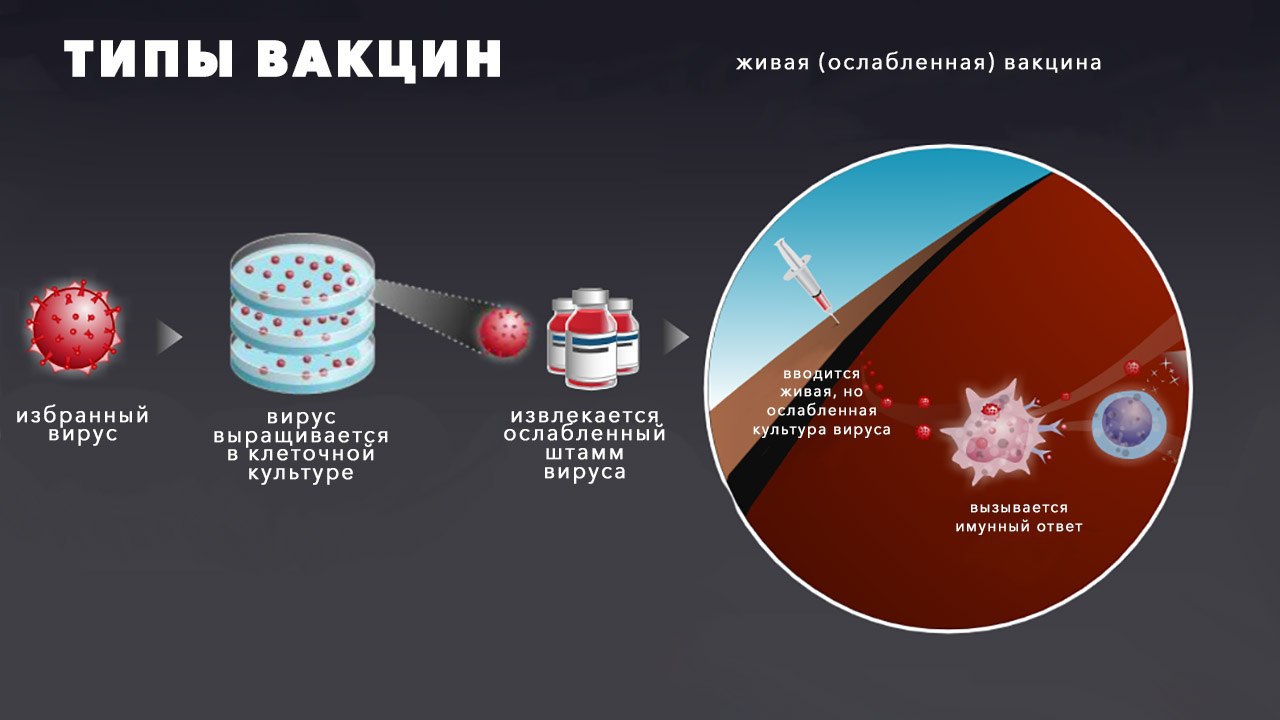
Самыми первыми стали вакцины, созданные из ослабленного возбудителя болезни. Ослабить его можно, выращивая в специальных условиях. Например, берём человеческий вирус и выращиваем его в клетках какого-нибудь животного, да ещё и при пониженной температуре. Исходно вирус приспособлен к клеткам человека и человеческой же температуре. Но среди вирусных частиц обязательно будут такие, которые хоть как-то смогут выжить в новых обстоятельствах. (Разумеется, новые условия подбирают так, чтобы вирус смог частично выжить, а не погиб сразу.) В следующем поколении выживших вирусных частиц станет больше, и чем дальше, тем лучше вирус будет приспосабливаться к пониженной температуре и новому месту жительства. По сути здесь происходит тот же искусственный отбор, как при создании пород собак, коров, кур и т. д. Но, приспосабливаясь к новым условиям, вирус станет забывать, как жить в клетках человека. Нельзя делать всё на свете одинаково хорошо, в чём-то ты будешь лучше, в чём-то хуже. И вот в результате мы получаем ослабленный, или аттенуированный вирус, который способен какое-то время прожить в человеческом организме, способен размножаться в человеческих клетках, но не способен человеку сильно навредить. Организм с ним быстро справится, а иммунитет получит представление о вирусе и запомнит его на будущее.
Аттенуированные вакцины делают против кори, свинки, гриппа и других болезней. Одна из самых известных таких вакцин — противотуберкулёзная БЦЖ*. Её создали в 1921 году, и до сих пор она остаётся единственной эффективной вакциной против туберкулёза. В её основе бактерия, поражающая крупный рогатый скот, — бычья туберкулёзная палочка. У человека она может вызвать полноценный туберкулёз, но сама она редко перескакивает от животных к человеку. Для вакцины бычью палочку выращивают на специальной питательной среде, на которой она спустя ряд поколений становится неопасной для человека.
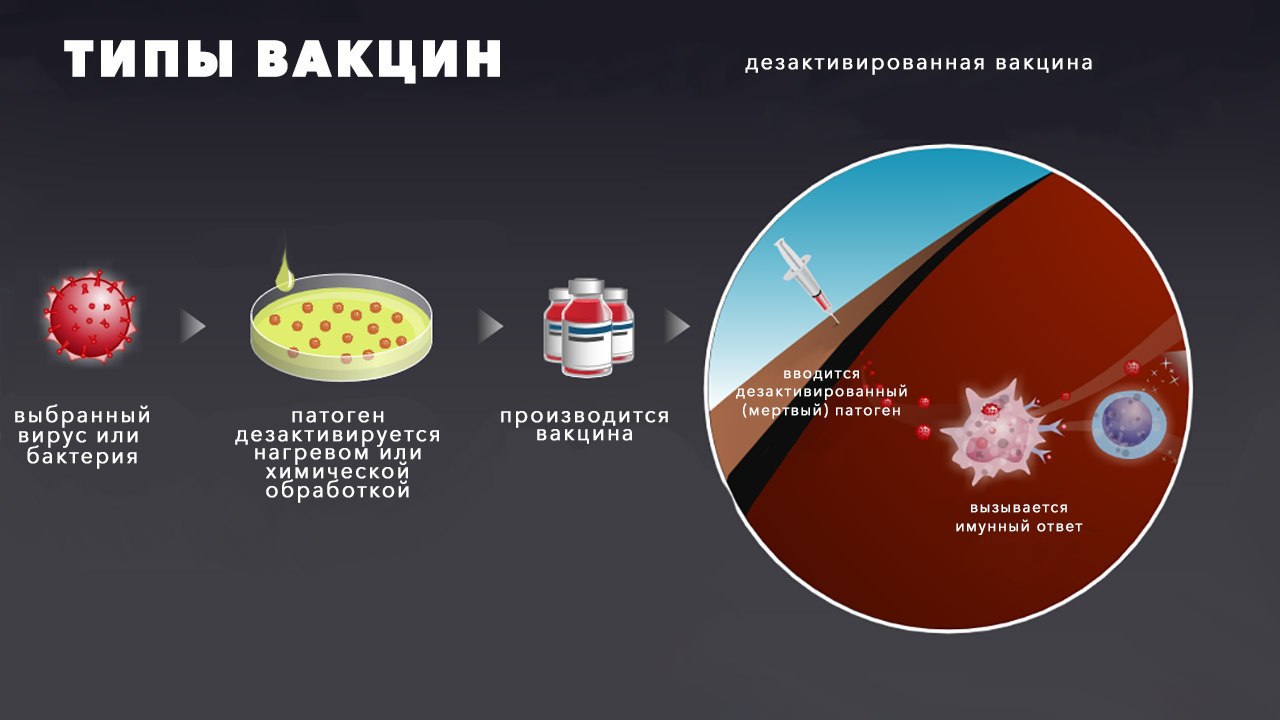
Можно, не занимаясь аттенуацией, сразу убить (инактивировать) возбудителя и вводить в организм уже мёртвые бактерии или инактивированные вирусные частицы. Инактивировать можно температурой, радиоактивным излучением, каким-то химическим препаратом. Вирус или бактерия утратят способность размножаться, но сохранят характерные молекулярные признаки, которые может запомнить иммунитет. Такие вакцины используют против коклюша, полиомиелита, гепатита А. Против нового коронавируса SARS-CoV-2 вакцины с убитым вирусом создали у нас в Федеральном научном центре исследований и разработки иммунобиологических препаратов им. М. П. Чумакова (вакцина «КовиВак»), в Китае (CoronaVac и BBIBP-CorV), в Индии (Covaxin), завершаются испытания британской Valneva COVID-19 vaccine.
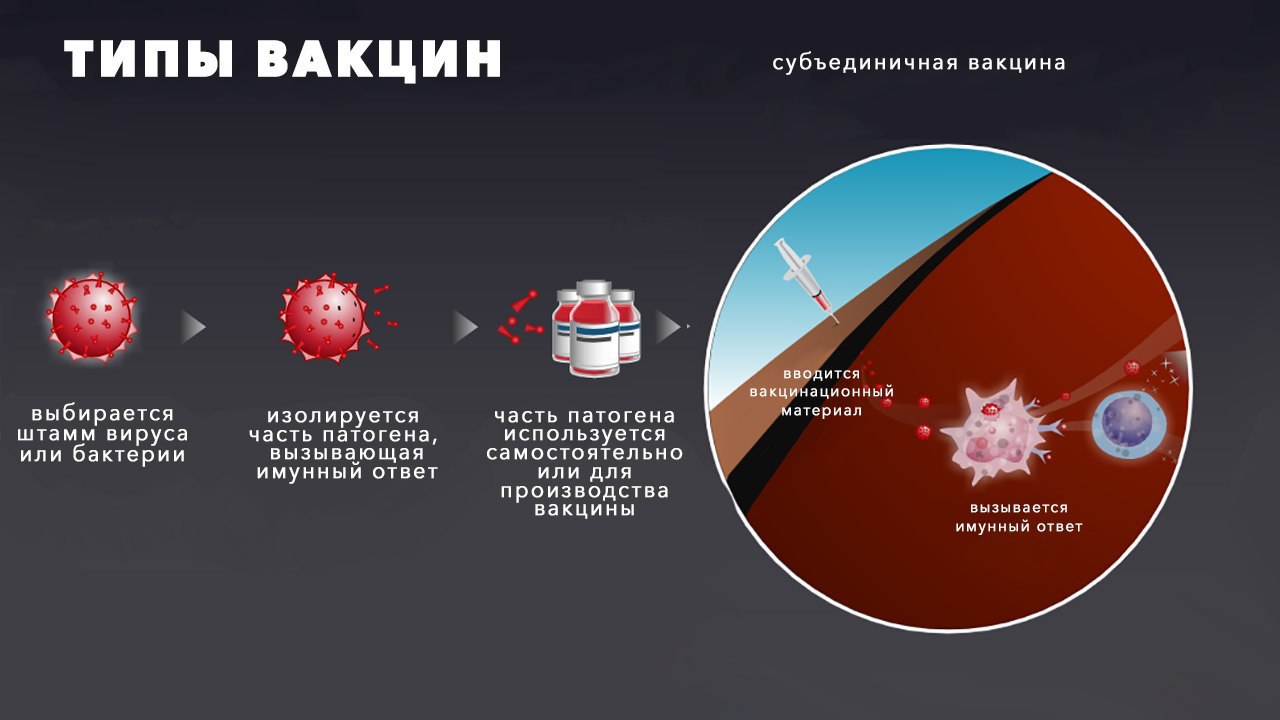
Другой вариант — показать иммунитету не возбудителя целиком, а только его часть. Если иммунные клетки реагируют на какие-то чужеродные молекулы, то вот этими молекулами и можно ограничиться. Такие вакцины называют субъединичными, от слова subunit — субъединица, часть. Антигенов (то есть молекул, на которые реагирует иммунитет и которые он может запомнить) в таких вакцинах может быть несколько, а может быть только один — какой-нибудь белок или его фрагмент-пептид. Его можно получить из самого возбудителя, разрушив бактериальную клетку или вирусную частицу, и потом извлечь нужный белок из молекулярных обломков. Можно синтезировать пептид из аминокислот с нуля, реакциями химического синтеза. А можно подключить генную инженерию, которая оказывается особенно кстати в тех случаях, когда антиген представляет собой белок.
Любой белок — это последовательность аминокислот, от неё зависит пространст-венная структура белка и его функции. Последовательность аминокислот зашифрована в геноме. Чтение генома и анализ аминокислотной последовательности у белков сейчас стало практически рутинной процедурой — особенно, если речь идёт о вирусах, чьи геномы очень невелики и кодируют всего небольшую горстку белков. ДНК, которая кодирует какой-то вирусный белок (или его фрагмент-пептид), можно размножить в пробирке и методами генетической инженерии внедрить в лабораторные бактерии. Бактерии будут работать биосинтетическим заводом, производящим огромные количества нужного белка. ДНК, кодирующую белок, вставляют в бактериальную плазмиду** — небольшую кольцевую ДНК, которая существует в клетке независимо от большой бактериальной хромосомы. Получается рекомбинантная (гибридная) ДНК, и белок, который получают с её помощью, тоже называют рекомбинантным. Останется только добыть его из бактериальных клеток, а это тоже давно уже рутинная биотехнологическая процедура.
К вакцинам против SARS-CoV-2 на основе вирусного пептида относятся «ЭпиВакКорона», созданная в Научном центре вирусологии и биотехнологии «Вектор» (это три вирусных пептида, синтезированные химически), и китайская RBD-Dimer.
Ещё один вариант — когда вакцинный вирусный пептид синтезируют не в лаборатории (будь то химический синтез или с помощью бактерий), а поручают эту работу собственным клеткам человека. Фрагмент ДНК, кодирующий вирусный пептид, вводят в организм — например, в мышцы — и дальше наши клетки начинают сами синтезировать пептид и показывать его иммунной системе. Фрагмент ДНК вводят не сам по себе, его внедряют в более крупную молекулу ДНК — в плазмиду или в геном какого-нибудь модифицированного обезвреженного вируса. В составе плазмиды или вирусного генома «пептидная» ДНК сможет работать, то есть на неё обратят внимание белковые машины, которые синтезируют РНК (как мы знаем, генетическая информация сначала копируется в РНК, а уже на РНК синтезируется белок). Кроме того, если вакцинная ДНК вставлена в геном вспомогательного вируса и находится внутри вирусной частицы, то в таком виде ей легче проникнуть в клетку. Вакцины против SARS-CoV-2, основанные на ДНК, это наш «Спутник V», созданный в Национальном исследовательском центре эпидемиологии и микробиологии им. Н. Ф. Гамалеи, и совместная вакцина AZD1222 биотехнологиче-ской компании AstraZeneca и Оксфордского университета (Великобритания).
Если на этом месте кому-то пришло в голову, что в качестве вакцины можно вводить не ДНК, а сразу РНК, то это мысль правильная. Наши клетки устроены так, что молекулы РНК синтезируются у них в клеточном ядре, а потом выходят в цитоплазму, где на них синтезируются белки. То есть вакцинная ДНК должна проникнуть сначала в цитоплазму, потом в ядро, здесь с неё снимут РНК-копию, и эта РНК-копия должна вернуться в цитоплазму. Упростим задачу и сделаем вакцину на основе РНК: она проникнет в цитоплазму и на ней сразу начнёт синтезироваться иммуногенный пептид. РНК-вакцины против коронавируса сделал биотехнологический гигант Pfizer в сотрудничестве с немецкой фирмой BioNTech (вакцина Comirnaty) и американская компания Moderna вместе с Национальным институтом аллергии и инфекционных заболеваний (NIAID) и Управлением перспективных биомедицинских исследований и разработок.
Эффективность и безопасность
Если вспомнить, что вакцина решает задачу, как переболеть болезнью, не болея ею, то становится понятно, почему придумано столько разновидностей вакцин. Аттенуированный вирус больше всего похож на настоящий возбудитель болезни. Собственно, это он и есть, только почти лишившийся умения жить в человеческих клетках. И теперь он способен лишь едва-едва размножаться, поэтому иммунитет его быстро «съедает». Однако есть вероятность, пусть и очень небольшая, что среди ослабленных вирусных частиц появится такая, которая мутирует обратно и вернёт себе способность эффективно плодиться в клетках человека. Например, долгое время в вакцине от полиомиелита использовали ослабленный живой вирус. Но примерно в одном случае на миллион прививка приводила к настоящему полиомиелиту. Одна вакцинная доза на миллион — это очень редко. Но в идеале такого вообще не должно происходить никогда. Поэтому живую антиполиомиелитную вакцину со временем заменили неживой, в которой вирус просто инактивирован.
И уж конечно, когда используют фрагмент вирусного белка, ни о чём подобном и речи быть не может. Кусок вирусной молекулы — это не вирус, он не будет размножаться в клетках и не спровоцирует настоящую болезнь.
Но чем меньше вакцина похожа на исходного возбудителя, тем больше приходится думать о её эффективности. Достаточно одной-двух доз живой вакцины, и иммунитет запомнит её на всю жизнь. Для остальных приходится подбирать усилители иммунного ответа, оптимизировать схемы иммунизации, делать прививки несколько раз в течение жизни и т. д. Чтобы понять, почему так происходит, нужно ещё глубже заглянуть в молекулярную биологию и в иммунологию.
Когда иммунная система встречается с патогеном, она видит в нём сразу несколько молекул, на которые можно нацелиться. «Несколько» может быть довольно большим числом: например, у бактерии, вызывающей коклюш, есть более 3000 потенциальных антигенов — то есть молекул, способных вызвать иммунный ответ. Некоторые из них вызовут очень сильную иммунную реакцию, некоторые — очень слабую, но, так или иначе, иммунная система в состоянии ударить по огромному числу мишеней на коклюшной бактерии. Тогда как вакцины против коклюша — те из них, которые сделаны на основе отдельных бактериальных белков, — включают в себя не более пяти этих самых белков. То есть иммунная система учится распознавать возбудителя по очень урезанному портрету. И тут возникает первая проблема: если уж мы делаем вакцину на основе отдельных антигенов, нужно выбрать такие антигены, на которые иммунитет реагирует сильнее всего, которые обладают большей иммуногенностью.
Другая проблема связана с тем, что молекулы-антигены в бактериальной клетке или вирусной частице существуют в определённом окружении: они взаимодействуют с белками, липидами, углеводами, огромным числом других молекул, больших и малых. Эти взаимодействия определяют, как выглядит молекула-антиген. Если вырвать её из привычного окружения, её простран-ственная структура может измениться, пусть и совсем чуть-чуть. Но иммунная система, натренированная распознавать чуть-чуть изменённый антиген, будет хуже распознавать его в обычном, естественном виде.
Ещё одна тонкость связана с тем, как формируется иммунная память. Выше говорилось, что за адаптивный иммунитет и иммунную память отвечают В- и Т-лимфоциты и связанные с ними белки. На самом деле, и В-, и Т-лимфоцитов существует множество разновидностей, каждая со своей функцией. Но если совсем не погружаться в подробности, то вкратце роль тех и других можно описать следующим образом. В-лимфоциты отвечают за синтез специфичных антител, или белков-иммуноглобулинов. Антитела связываются с чужеродными молекулами, причём именно с теми, против которых они синтезированы, обезвреживают их и приманивают к ним иммунные клетки. Т-лимфоциты сами уничтожают патогены и заражённые ими клетки.
Тонкость в том, что для эффективного иммунного ответа заражённые клетки должны показать лимфоцитам, что они больны. Например, если в клетку проник вирус, то на её поверхности должны появиться фрагменты вирусных белков. Как это происходит, тема для отдельного разговора, нам сейчас достаточно того, что лимфоцит «щупает» клетку и, если чувствует на ней куски вирусных белков, понимает, что клетка больна. Подобным образом фрагменты чужеродных молекул предъявляют лимфоцитам иммунные клетки из отдела врождённого иммунитета. Это называется презентацией антигенов, и с ней адаптивный иммунитет включается в полную силу, как со стороны В-клеток, так и со стороны Т-клеток. Соответственно, память об инфекции будет формироваться лучше.
Но когда вакцина сделана на основе одного-двух-трёх вирусных пептидов, а в клетках вируса нет, иммунитет будет учитывать только те чужеродные вакцинные молекулы, которые плавают во внеклеточном пространстве. В этом случае иммунная реакция может оказаться не слишком сильной, а иммунная память не слишком прочной.
В общем, получается, что лучшая вакцина — это сама болезнь. Но мы никому не будем советовать переболеть туберкулёзом или полиомиелитом, чтобы от них защититься. Уж лучше как-то повысить эффективность вакцин. Одна из самых известных уловок — добавление в вакцину так называемого адъюванта. Адъювант — сложная смесь веществ, в которую могут входить неорганические соединения алюминия, витамин Е, глицерин, сложные углеводороды вроде сквалена и другие вещества. Адъювант работает как усилитель иммунного ответа, с ним В-клетки вырабатывают больше антител, с ним больше шансов на то, что на вакцину отреагируют Т-клетки и появятся соответствующие Т-клетки памяти. Механизм действия у адъювантов разный. Например, соли алюминия стимулируют врождённый иммунитет, а поскольку адаптивный иммунитет включается с подачи врождённого, то получается, что соли алюминия через врождённый иммунитет усиливают реакцию адаптивного иммунитета. Органические вещества, вроде витамина Е и сквалена, образуют в водной среде жировые капельки, которые собирают на себе вакцинный антиген. Получается что-то вроде микродепо с большим скоплением чужеродных молекул. В таком виде антиген дольше задерживается в организме, а значит, иммунитет будет его дольше видеть. Большая локальная концентрация антигенных молекул тоже помогает стимулировать иммунную реакцию. Адъювант не нужен живым вакцинам, но его часто добавляют в вакцины из убитых патогенов и в субъединичные вакцины, сделанные на основе отдельных молекул-антигенов: с адъювантом человеку вводят меньше доз вакцины, чем без него. Адъювант с гидроксидом алюминия есть в наших антикоронавирусных вакцинах «КовиВак» и «ЭпиВакКорона».
Другой способ повысить эффективность вакцины — взять антиген и поместить его в привычное молекулярное окружение. Выше мы говорили, что вирусный белок сам по себе и вирусный белок в окружении других белков или липидов часто выглядит по-разному. И вот мы берём этот белок и делаем для него вирусоподобную частицу. Соб-ственно, её можно сделать из белков того же вируса, против которого мы создаём вакцину. Вирусные белки способны самопроизвольно собираться вместе. При правильно подобранных условиях белковые молекулы, до поры до времени плавающие в растворе поодиночке, слипнутся в вирусоподобный шарик. В нём не будет нуклеиновой кислоты, поэтому размножаться такой псевдовирус не сможет. Другой вариант — смешать белки от разных вирусов, чтобы они образовали вирусоподобную частицу, в которую будет встроен нужный белок от того вируса, против которого мы делаем вакцину. Наконец, вирусоподобную частицу можно сделать из липидных молекул, которые в растворе тоже образуют микроскопические шарики. У многих вирусов есть липидная оболочка, в которую воткнуты вирусные белки, и эти белки лучше всего себя чувствуют именно в липидном окружении. Кроме того, вирусоподобные частицы легко проникают в клетку, имитируя заражение, а иммунитету для наиболее эффективной реакции хорошо бы получить сигнал от заражённой клетки.
По сути ДНК- и РНК-вакцины можно рассматривать как усилители субъединичных вакцин. ДНК или РНК тоже имитируют заражение: они кодируют молекулу-антиген и проникают в клетку, которая этот антиген начинает синтезировать. Антиген появляется на наружной мембране клетки, где его замечают иммунные клетки и запускают полноценный иммунный ответ. Но с ДНК- и РНК-вакцинами есть проблема: как заставить ДНК и РНК проникнуть в клетку?
Есть разные способы решить эту задачу, один из них — использовать так называемый вирусный вектор. Так называют какой-нибудь изначально малоопасный вирус, который специально модифицировали так, чтобы он по-прежнему легко проникал в клетки, но уже никак не мог размножаться. Если такой вирус нагрузить вакцинной ДНК или РНК, он легко перевезёт её внутрь клеток.
На таком принципе работают вакцины против SARS-CoV-2 «Спутник V» и AZD1222 (AstraZeneca): у них фрагмент ДНК, кодирующий белок коронавируса, встроен в обезвреженный человеческий аденовирус (в «Спутнике V») и в аденовирус шимпанзе (в вакцине от AstraZeneca). (На всякий случай скажем, что аденовирусы, использованные в вакцинах, даже в своём естественном, немодифицированном виде не вызывают ничего серьёзнее простуды.) В РНК-вакцинах компаний Pfizer–BioNTech и Moderna для транспортировки РНК, кодирующей вирусный белок, использованы липидные наночастицы, которые широко применяются везде, где нужно препроводить какое-то вещество внутрь клетки.
Словом, по мере развития биотехнологий вакцины становятся всё менее похожими на настоящий возбудитель болезни и всё более безопасными. Значит ли это, что у них нет побочных эффектов?
Побочные эффекты, мнимые и реальные
Есть очень известная история, связанная с вакцинами и аутизмом. В 1998 году несколько британских врачей опубликовали в журнале «The Lancet» статью, в которой утверждалось, что у двадцати детей вскоре после прививки вакциной КПК (комбинированная вакцина от кори, свинки и краснухи) появились симптомы аутизма и других заболеваний. Однако спустя несколько лет стало ясно, что нет никакой связи между вакциной КПК и аутизмом. Авторы статьи в журнале «The Lancet» устроили откровенный подлог с целью поднять акции другой, конкурирующей вакцины. В 2010 году «The Lancet» отозвал статью (так называется специальная процедура, которая отменяет факт публикации и делает результаты работы недействительными для науки). Её главного автора исключили из медицинского реестра Великобритании, что по сути означает запрет на профессию. Тем не менее, многие люди до сих пор пугают друг друга вакцинным аутизмом, причём в роли страшной вакцины выступает уже абсолютно любая вакцина, а не только КПК. Почему так происходит, обсуждать можно долго, тут есть и вина СМИ, которым нужно продаваться, и отдельных людей, которые берут от научных результатов только то, что ублажает их собственные фантазии.
И всё же побочные эффекты у вакцин есть. У кого-то после прививки долго болит и опухает место укола, у кого-то появляется сыпь, кого-то постоянно клонит в сон, кого-то лихорадит. Кто-то вспомнит случаи, когда после прививки начиналась пневмония, а то и энцефалит. Что на это можно ответить? Повторим ещё раз — вакцина имитирует болезнь, современные вакцины имитируют её наиболее безопасным способом. Но, так или иначе, при вакцинировании в организме появляется нечто, напоминающее инфекцию, и иммунитет начинает реагировать. А симптомы любой инфекционной болезни складываются, во-первых, из деятельности самого патогена (который выделяет токсины и разрушает клетки), а во-вторых, из деятельности иммунитета. Первым на опасность реагирует врождённый иммунитет, который даёт воспаление, отёк, повышенную чувствительность к боли и пр. Воспалительная реакция — это иммунное оружие, однако его действие чувствуют на себе не только патогены и заражённые клетки, но и здоровые ткани.
Важно, что негативные эффекты ничтожны по сравнению с настоящей болезнью. Что до тех случаев, когда после вакцины начинается именно настоящая болезнь, то тут в пример можно привести статистику по той же вакцине КПК против кори, свинки и краснухи. Так, при кори риск пневмонии составляет один случай на двадцать заболевших (и именно пневмония становится основной причиной смерти детей, заболевших корью). Тогда как при вакцинировании вероятность пневмонии после прививки составляет два случая на миллион. Вероятность энцефалита при кори составляет один случай на тысячу заболевших, при свинке — один случай на 300—6000 заболевших, при краснухе — один случай на шесть тысяч. При вакцинировании же — один случай на три миллиона прививок.
Кто-то может сказать, что все его знакомые взрослые и дети никогда не ставили себе прививку КПК и при этом никогда не болели ни корью, ни свинкой, ни краснухой. Но инфекционные болезни приходят к нам не только из грязной воды или еды, они ещё распространяются от одного человека к другому. Если ребёнок не прививался от свинки, но живёт в окружении людей, которым прививку делали, то свинка до него просто не долетит. Иными словами, те, кто не делает прививки, спасаются от инфекций за счёт привитых. До поры до времени привитых людей будет достаточно, чтобы сдерживать вспышку болезни. Но если всё больше людей будут отказываться от вакцин, ситуация начнёт меняться, пусть и не быстро. Эти изменения видны в первую очередь эпидемиологам. Так, в 1998 году в Великобритании было зарегистрировано 56 случаев кори. Но после того, как в том же 1998 году была опубликована статья про аутизм и вакцину КПК, уровень вакцинации в стране упал с 92% до 80%, и к 2008 году было зарегистрировано 1348 случаев кори с двумя смертельными исходами.
Однако в некоторых случаях вакцинирование действительно требует повышенной осторожности. В составе вакцины могут быть аллергены, которые способны спровоцировать иммунную реакцию вплоть до тяжёлого анафилактического шока. В вакцине КПК попадаются следовые количества антибиотика неомицина — хотя его там совсем немного, человек с аллергией на неомицин его почувствует. Вирус гриппа для вакцины выращивают в куриных яйцах, следовательно, человеку с аллергией на яйца желательно выбрать вакцину, которую при изготовлении специально избавили даже от следов яичного белка. Наконец, аллергены могут быть в составе адъюванта. Здесь всё зависит от того, что сам человек знает про свой иммунитет (то есть делал ли он анализ на аллергены), и от того, как организовано вакцинирование, то есть спрашивают ли у человека, есть ли у него аллергии, предупреждают ли о возможной аллергической реакции.
Другая группа случаев, когда вакцинироваться следует с оглядкой, связана с аутоиммунными невропатиями. Одна из таких невропатий называется синдромом Гийена — Барре. При синдроме Гийена — Барре иммунитет атакует миелин — липидную обмотку на отростках нервных клеток. Эта липидная обмотка ускоряет электрические импульсы и изолирует нейронные «провода» друг от друга. Если миелиновая оболочка вокруг нейронных отростков исчезает, возникают проблемы с проведением импульсов. Как можно догадаться, симптомы тут очень разные, от слабости в ногах и руках и утраты ощущений в них до дыхательной недостаточности и нарушений сердечного ритма. Синдром Гийена — Барре развивается после некоторых инфекций, например, после гастроэнтерита или после респираторных инфекций. Вакцина в какой-то степени напоминает инфекцию, поэтому в некоторых случаях синдром Гийена — Барре регистрируют после прививки. Однако вакцинные эпизоды синдрома чрезвычайно редки. Например, при массовой вакцинации во время пандемии «свиного» гриппа в 2009 году синдром Гийена — Барре имел место с частотой один на миллион доз вакцины.
Несколько лет назад в «Journal of Child Neurology» были описаны случаи, когда противостолбнячная вакцина вызывала невропатию, похожую на болезнь Шарко — Мари — Тута (ШМТ). Она тоже возникает при повреждениях миелиновой обмотки на нейронах, и причиной тому целый ряд мутаций, передающихся по наследству. Иногда симптомы ШМТ начинаются в раннем дет-стве, иногда — лишь в 20—30 лет. В статье в «Journal of Child Neurology» речь шла о новых мутациях, которые с ШМТ и похожими на неё невропатиями до сих пор никто не связывал, хотя эти новые мутации сопутствовали схожим симптомам. По словам авторов работы, вероятнее всего, невропатию запустила вакцина; однако не исключено, что, если бы вакцины не было, болезнь началась бы после какой-нибудь инфекции.
Здесь важно не пропустить слово «мутации». Во многих случаях предрасположенность к аутоиммунным расстройствам тоже можно увидеть в генах. Очевидно, что для того, чтобы вакцины не провоцировали аутоиммунные проблемы, нужно сделать так, чтобы генетический анализ был доступен каждому — во всяком случае, в рамках программы вакцинации. Если же оставить генетику в покое (поскольку не все аутоиммунные болезни начинаются именно из-за генов), то можно было бы просто тщательнее проверять иммунитет у тех, кто собирается вакцинироваться, и сопоставлять текущее состояние иммунитета с медицинской историей человека. В конце концов, угроза аутоиммунной реакции не означает, что вакцинироваться вообще нельзя. Во-первых, есть практика вакцинации детей с аутоиммунными расстройствами, когда вакцину сопровождают препараты-иммуносупрессоры. Они не дают иммунной системе разыграться до аутоиммунного приступа и при этом не мешают адекватно ответить на вакцину и сформировать иммунную память. Во-вторых, вакцин существует много, и биотехнологии, как говорится, не стоят на месте. Если у человека аллергия на адъювант, то ему нужно поставить вакцину без аллергена, даже если она более дорогая, чем вакцина с адъювантом. Конечно, искать и покупать такую вакцину он должен не сам, а организация, отвечающая за вакцинирование.
Наконец, стоит упомянуть ещё один фактор, от которого зависит безопасность вакцины. Правда, фактор этот к науке не относится. Мы имеем в виду обычную халатность. В 1955 году началась массовая вакцинация от полиомиелита в США. Но вскоре стали появляться сообщения о полиомиелитном параличе, который случался как раз после прививки. Вакцина была основана на обезвреженном вирусе. Оказалось, что фирма, производящая вакцину, выпустила более сотни тысяч доз, в которых вирус не был обезврежен надлежащим образом. Огромное число людей получили не вакцину, а сам полиомиелит. Заболело около 40 тыс. людей, 250 парализовало, 10 умерло. Несмотря на объяснения официальных лиц, вакцинацию ждал бы полный провал, если бы не Элвис Пресли. Минздрав США уговорил Элвиса сделать прививку в прямом эфире. 28 октября 1956 года на телешоу ему ввели вакцину. Подростки, фанатевшие от Элвиса и состоявшие в группе риска, ринулись делать прививку вслед за ним. Вывод из этой истории в первую очередь касается вакцинных производителей и разнообразных медицинских администраторов: случись что, нового Элвиса под рукой может и не оказаться.
Чтобы с понятием «антиген» не возникало путаницы, уточним, что антигены — это не химический класс веществ, подобно белкам, жирам, углеводам и пр. Антиген — это то, что иммунитет воспринимает как чужое, то, против чего появляются антитела. Собственно, слово «antigen» образовано от двух: antibody generator — «производитель антител». Чаще всего антигенами бывают белки или полисахариды (из тех, что входят в состав клеточной стенки бактерий). Молекулярные гибриды, вроде липопротеинов, гликопротеинов, липополисахаридов, тоже работают как антигены. В свою очередь, антитела — это всегда белки иммуноглобулины. Их синтезируют плазматические клетки, образующиеся из В-клеток, которые почуяли опасность. Антитела хватают антиген за определённый участок антигенной молекулы. Антигены — обычно довольно крупные молекулы, в них есть участки, более доступные для иммунитета и менее доступные. Фрагмент молекулы антигена, с которым могут связаться антитела, называется эпитопом. У одного антигена может быть несколько эпитопов. Доступность эпитопов для антител зависит от простран-ственного строения всей молекулы.
Обычно говорят, что на разработку вакцин уходят годы. А вакцины против SARS-CoV-2 появились, когда и года не прошло. Как такое могло получиться?
Во-первых, нужно учитывать, что технологии создания вакцин давно разработаны. ДНК-вакцины, на первый взгляд, кажутся последним словом биотехнологии, но одни из первых экспериментов с ДНК-вакцинами были поставлены ещё в начале 1990-х годов. С точки зрения науки, для вакцин против SARS-CoV-2 ничего нового изобретать не пришлось.
Во-вторых, много времени занимают клинические исследования на добровольцах, которые проходят в три этапа. Если на первом этапе участвуют несколько десятков добровольцев, то на третьем — уже несколько тысяч, а то и десятков тысяч. Кроме того, третий этап выполняют сразу в нескольких научных центрах, чтобы получить наиболее объективные данные. Цель клинических исследований: выявить возможные побочные эффекты и определить наиболее эффективные дозы. Если побочные эффекты достаточно серьёзны, они проявятся сразу на небольшом числе добровольцев, и не будет нужды подвергать опасности тысячи людей. В то же время, чем больше участников исследования, тем больше времени нужно, чтобы организовать клинический эксперимент, собрать данные, проанализировать их и перепроверить. В случае с «ковидными» вакцинами было решено объединить этапы клинических исследований друг с другом: то есть добровольцев было не слишком мало, но и не слишком много, а результаты вакцинирования оценивали не только сами разработчики вакцины, но и официальные представители государственного здравоохранения. Ускоренное тестирование вакцин позволило определить эффективные дозы и убедиться, что резких и быстро проявляющихся отрицательных побочных явлений от них нет. Тем не менее разработанные вакцины пока что применяют в рамках продолжающейся эпидемии; для обычной рутинной вакцинации их не рекомендуют. Когда эпидемия COVID-19 сойдёт на нет, вакцины продолжат изучать на предмет безопасности.
Наконец, в-третьих, — создание вакцин, как и любых лекарств, требует денег, которые ещё нужно где-то найти. Поскольку эпидемия COVID-19 напугала всех, то разработчикам вакцин постарались создать наиболее благоприятные административно-экономические условия.
Эффективность вакцины зависит от того, как она сделана, и от человека, которому её ставят. Известно, что у людей с ослабленным иммунитетом вакцины работают с меньшей эффективностью. Иммунитет, в свою очередь, зависит от разных факторов, от питания до возраста. Но когда говорят, что у нас до сих пор нет постоянной вакцины против гриппа, то имеют в виду другое. Иммунитет запоминает патоген по молекулярным особенностям. Но вирус гриппа легко мутирует — его белки, на которые реагирует иммунитет, регулярно меняются. Сам вирус такие изменения переносит нормально, иммунитет же всякий раз сталкивается как будто с новым вирусом. Каждый раз, как появляется новый штамм вируса гриппа, против него создают новую вакцину. Ещё легче мутирует вирус иммунодефицита человека: он регулярно меняется, оставаясь внутри одного и того же больного, поэтому иммунитет не может с ним справиться и поэтому против него до сих пор вообще нет вакцины. Однако даже в белках даже очень изменчивых вирусов есть участки, которые не могут меняться, в противном случае белок просто перестанет работать. Возможно, проблему с меняющимися патогенами можно решить, научив иммунитет атаковать их по неизменяющимся зонам молекул.
Комментарии к статье
* Сокращение БЦЖ пришло из французского языка: BCG, или Bacillus Calmette–Guerin, бацилла Кальмета–Герена. Альбер Кальмет и Жан-Мари Камиль Герен в 1913 году впервые вывели ослабленный штамм бычьей туберкулёзной палочки, который можно было использовать для вакцинации.
** Плазмидой называется небольшая кольцевая молекула ДНК, существующая независимо от основной ДНК, в которой закодирована большая часть генетической информации. В естественном виде плазмидами пользуются преимущественно бактерии. В животных клетках плазмид нет, но их можно в них ввести ради каких-то биотехнологических или медицинских задач.
Выбор вакцины для ревакцинации
Появление новых штаммов коронавирусной инфекции повысило интерес людей к ревакцинации. В большинстве регионов России первую вакцинацию проводили препаратом «Спутник V», который показал хорошие результаты, сдержал распространение COVID-19. Ревакцинация позволяет поддерживать высокий уровень антител, снижает риск инфицирования, защищает от осложнений.
Показания к ревакцинации
Процедура повторного введения дозы вакцины от коронавирусной инфекции называется ревакцинацией. Она рекомендована в связи с ухудшением эпидемиологической ситуации, появлением новых более заразных штаммов. При повторной вакцинации от COVID-19 человек получает дополнительную дозу вакцины (бустерную), которая стимулирует работу иммунитета, поднимает уровень антител против коронавирусной инфекции.
Врачи рекомендуют делать бустерную прививку через каждые шесть месяцев, чтобы защитить организм от опасного заболевания. Если первую вакцинацию рекомендовали делать двухкомпонентными вакцинами, для ревакцинации разрешены практически любые препараты, зарегистрированные на территории Российской Федерации.
Выбор вакцины для ревакцинации
Бустерная доза вакцины прежде всего направлена на защиту людей в группе риска: пожилых, с хроническими заболеваниями, ожирением, сахарным диабетом, гипертонией. Она снижает вероятность инфицирования при нахождении в общественном месте, позволяет без опасения вести активный образ жизни. Каждая новая доза вакцины усиливает и продлевает Т-клеточный иммунитет, улучшая качество антител.
Для ревакцинации можно использовать следующие вакцины:
- «Гам-Ковид-Вак» («Спутник V») – векторная вакцина, которая прошла клинические испытания. В качестве основного компонента используется ген аденовирусного S-белка.
- «Спутник Лайт» − относится к векторным вакцинам, фактически является первым компонентом вакцины «Гам-Ковид-Вак». Показывает высокую эффективность при ревакцинации, изготовлена на основе ослабленного «живого» вируса.
- «КовиВак» −цельновирионная инактивированная вакцина прошла доклинические исследования, позволяет «познакомить» иммунитет человека с полным белком вируса. Рекомендована для повторной прививки.
- «ЭпиВакКорона» − пептидный препарат содержит белок коронавируса и гидроксид алюминия, усиливающий иммунный ответ.
Повторное введение препаратов помогает организму запомнить возбудитель, быстрее реагировать при заражении. Врачам только предстоит разработать календарь прививок от COVID-19, изучить периодичность каждого препарата. В каждом случае специалисты стараются выбрать вакцину индивидуально с учетом хронических болезней, противопоказаний, возраста человека.
Последние новости
Записаться на прививку в медицинский центр или вызвать опытного врача-иммунолога в организацию можно по телефону в Москве: 8 (495) 374-79-43 или через форму ниже
Наши врачи
Педиатр, гастроэнтеролог, специалист по вакцинопрофилактике
Врач-педиатр, специалист по вакцинопрофилактике
Врач-педиатр, специалист по вакцинопрофилактике
Врач-педиатр, специалист по вакцинопрофилактике
Врач-педиатр, специалист по вакцинопрофилактике
Врач-педиатр, специалист по вакцинопрофилактике
Врач-педиатр, специалист по вакцинопрофилактике
Врач-педиатр, специалист по вакцинопрофилактике
Врач-педиатр, специалист по вакцинопрофилактике
Врач-педиатр, специалист по вакцинопрофилактике
Врач-педиатр, специалист по вакцинопрофилактике,
главный врач
Врач педиатр

Врач-педиатр, специалист по вакцинопрофилактике

Врач-педиатр, специалист по вакцинопрофилактике

Врач педиатр, главный врач

Врач-педиатр, специалист по вакцинопрофилактике

Зачем нужна вакцинация
Вакцинация или активная иммунизация — это широко применяемый в мире способ массовой профилактики инфекционных заболеваний, как вирусных (корь, краснуха, свинка, полиомиелит, гепатит В и др.), так и бактериальных (туберкулез, дифтерия, коклюш, столбняк и др.). Она не лечит болезнь, а предупреждает ее развитие.
Смысл вакцинации заключается в том, что в организм человека вводят вакцины — препараты, в составе которых находятся ослабленные или убитые возбудители различных инфекций или их отдельные части (антигены), способные вызвать иммунный ответ. Наш иммунитет реагирует на вакцину как на инфекцию, вырабатывая антитела, которые будут защищать нас в будущем. При этом саму болезнь вакцина вызвать не в состоянии.
Вакцина и прививка — одно и то же?
Прививка по своему определению — это процесс введения вакцины, этот термин произошел от глагола “прививать” и является синонимом вакцинации. Прививки делают по определенному графику, их отмечают в медицинской карте или прививочном сертификате. Соблюдать график прививок следует всем, особенно это касается людей, которые живут в тесных коллективах. В детских садах, школе или армии условия прекрасно подходят для распространения многих серьезных инфекций, передающихся воздушно-капельным путем или через еду и посуду.
При прививке от одной и той же болезни могут использоваться разные вакцины, например, детские препараты не всегда подходят для взрослых. Часто одна вакцина защищает сразу от нескольких заболеваний (как вакцина АКДС против коклюша, дифтерии и столбняка). Это помогает сократить количество инъекций и походов к врачу.
Миссия вакцин
Вакцины играют в нашей жизни незаметную, но очень большую роль. Вот их основные функции:
- Профилактика заражения. Прививки снижают риск заражения опасными инфекциями, формируя приобретенный иммунитет. Иммунная система «запоминает» антигены возбудителей болезни, которые вводятся вместе с вакциной. Позже при контакте с такими же возбудителями она распознает и уничтожает их.
- Профилактика осложнений. Пусть редко, но даже после введения вакцины можно заразиться дикой инфекцией и заболеть. Плюс в том, что в этом случае болезнь гораздо чаще протекает в легкой форме, а риск тяжелых осложнений и летального исхода для вакцинированных заболевших в разы меньше, чем для тех, кто не был привит. Например, иммунизация против туберкулеза в 5 раз снижает риск развития менингита и генерализованной формы этой инфекции.
- Защита от неизлечимых болезней. Для некоторых инфекций нет специфического лечения. Бешенство, которым можно заразиться после укуса или ослюнения больным животным, имеет 100% летальность. Около 99% случаев передачи вируса бешенства от животных к человеку сопряжено с укусами домашних собак. Единственный способ борьбы с этой болезнью — вакцина. Если вас укусили, сделать прививку нужно как можно скорее, до появления первых характерных симптомов (возбудимость, водобоязнь). Другой пример неизлечимой болезни — вирус папилломы человека, который является самой частой причиной рака шейки матки. От него нельзя избавиться, но предотвратить заражение можно, вовремя сделав прививку. Так как вирус передается половым путем, вакцину следует получить до начала половой жизни.
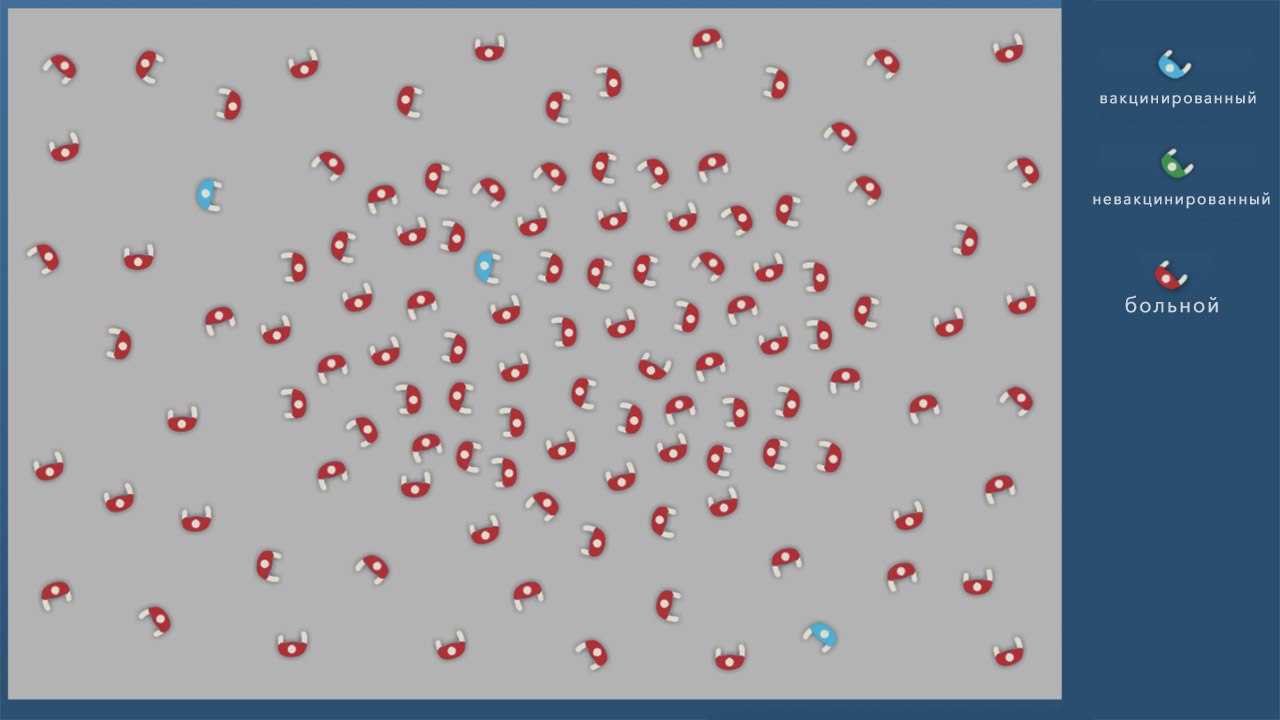
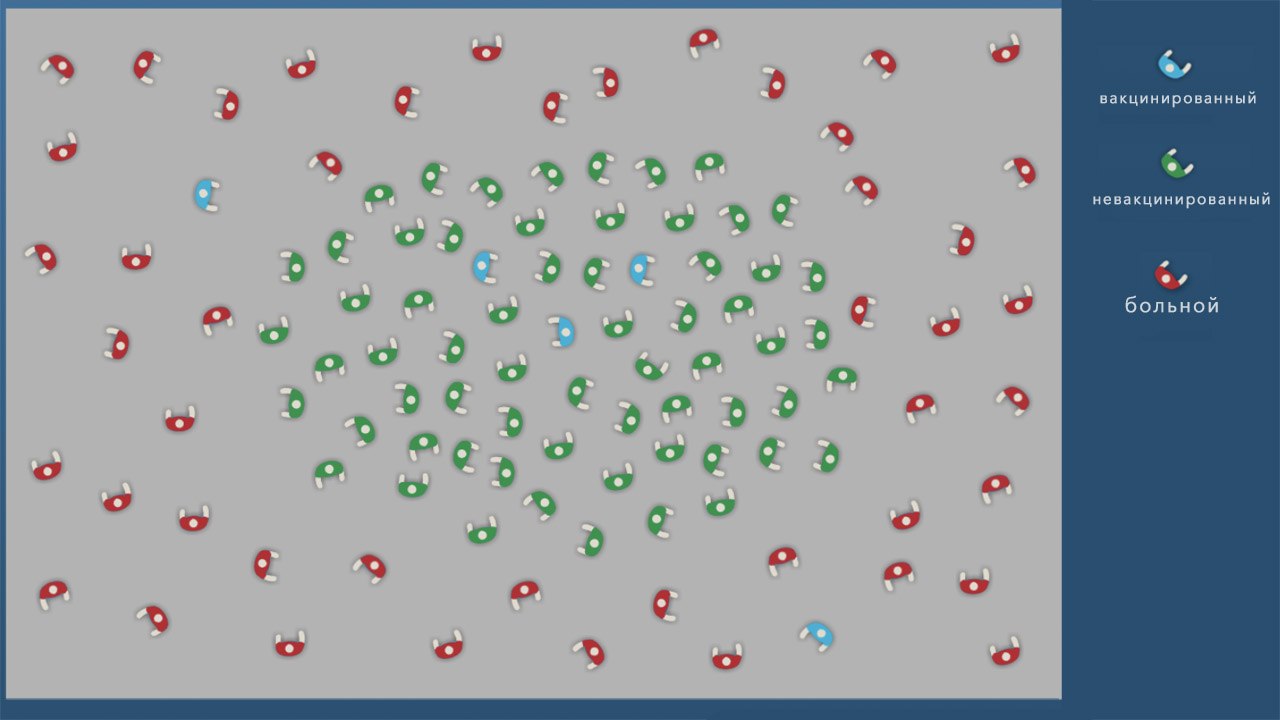
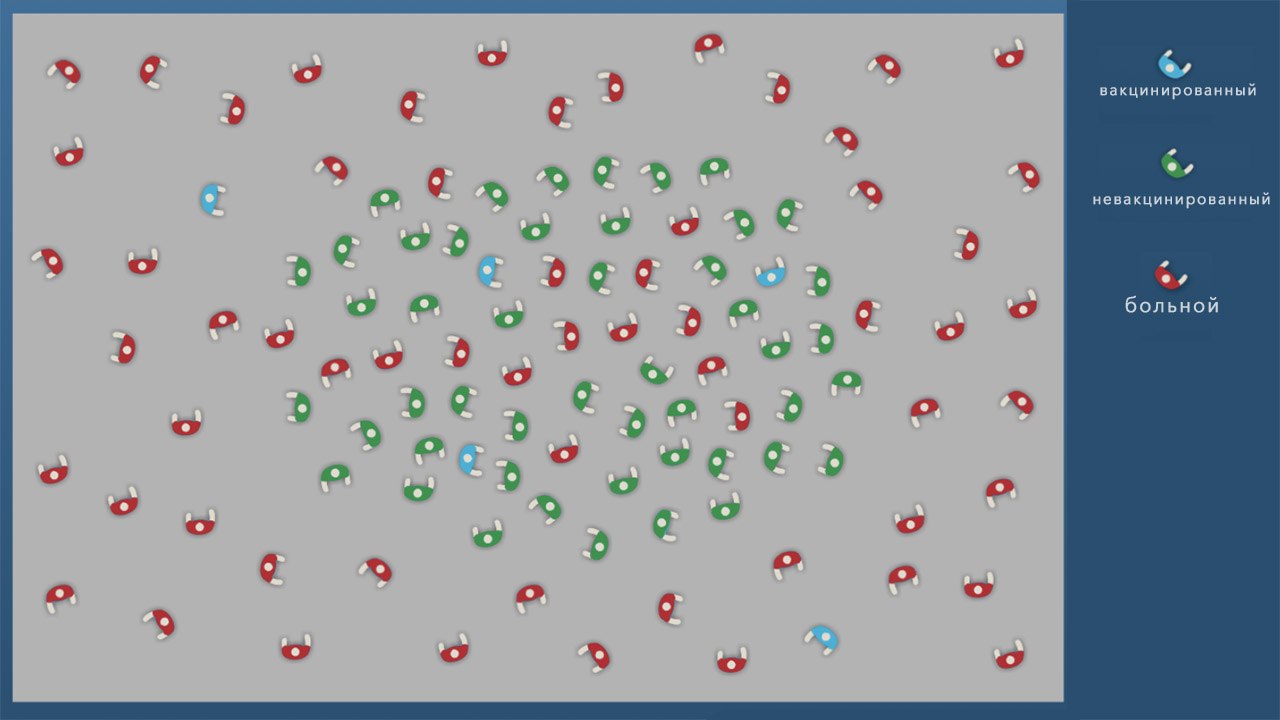
- Формирование коллективного иммунитета. Когда большая часть (не менее 70%) населения привита, инфекция перестает распространяться, и новых случаев заражения нет. При этом вакцинированные люди защищают непривитых, составляя их ближайшее окружение (рис. 1). Наличие коллективного иммунитета очень важно для тех, кто не может получить вакцину из-за противопоказаний. Если проводить вакцинацию достаточно широко (некоторые болезни невероятно заразны, и остановить их очень трудно), инфекция может полностью исчезнуть. Так произошло с натуральной оспой, последний случай заражения которой был зарегистрирован в 1979 году. Другой пример — полиомиелит. Пока он не побежден полностью, но опасных регионов на планете, где можно им заразиться, осталось очень мало. Сегодня это Афганистан, Пакистан и Нигерия.
А.
Б.
В.
Рисунок 1. Иллюстрация работы коллективного иммунитета. А — в обществе нет привитых, вспышка инфекции затрагивает почти всех. Б — большой процент привитых защищает часть людей, не получивших вакцину. В — привитых в обществе недостаточно, болезнь затрагивает почти всех восприимчивых людей. Источник
Как работают вакцины
После попадания вакцины в организм наша иммунная система реагирует на содержащиеся в ней антигены бактерий или вирусов — “визитные карточки” инфекции. В результате формируется иммунный ответ, который в будущем защищает нас от диких возбудителей. Моделируя инфекцию, прививка становится своеобразной тренировкой иммунитета.
Прививаться ли взрослым от ВПЧ?
«Вирус папилломы человека (ВПЧ) — самая распространенная в мире инфекция, передаваемая половым путем. Это исключительно коварный вирус: он может затаиться на десятилетия, а потом «выстрелить» различными заболеваниями половых органов — от доброкачественных папиллом до рака шейки матки. Будь прививка от ВПЧ бесплатной, я бы вообще рекомендовала делать ее абсолютно каждому человеку.
В 2018 году федеральное агентство США по контролю за безопасностью товаров и медикаментов (FDA) одобрило применение вакцины против ВПЧ (вирус папилломы человека) у лиц старше 27 и моложе 45 лет — причем, как у мужчин, так и у женщин. Отмечу, что до 27 лет эффективность вакцины была подтверждена давно. По данным этого исследования, вакцина безопасна для здоровья, при этом она на 88% снижает вероятность возникновения генитальных папиллом, предрака вульвы и влагалища, а также предрака и рака шейки матки.
Если говорить об идеальных сроках, то врачи рекомендуют прививать девочек до начала половой жизни (9-12 лет). И тут возникает закономерный вопрос — можно ли привиться в более старшем возрасте? Если ответить коротко, то да — и во взрослом возрасте есть смысл сделать прививку от этой инфекции. На сегодняшний день вакцина официально разрешена до 45 лет. Хотя, конечно, ее эффективность для взрослых не такая высокая, как для подростков».



Как работает иммунная система?
Иммунитет защищает внутреннюю среду организма от всего чужеродного, в первую очередь – от возбудителей инфекционных заболеваний. Иммунную систему принято разделять на две части:
- Врожденный иммунитет. Это та система защиты, которая бережет нас от болезней с самого рождения. К ней относятся анатомические и химические барьеры (кожа, слизистые и покрывающие их природные антимикробные соединения), система комплемента (защитные белки крови) и множество иммунных клеток крови (макрофаги — “пожиратели” микробов, дендритные клетки, гранулоциты, тучные клетки).
- Приобретенный иммунитет. Эта часть иммунитета отвечает за специфический иммунный ответ, который вырабатывается в течение жизни, когда наш организм сталкивается с новыми для себя микробами. Главные бойцы приобретенного иммунитета — это Т-лимфоциты (атакуют чужеродные клетки или помогают активировать другие иммунные клетки) и В-лимфоциты (вырабатывают защитные антитела). После активации часть из них становятся клетками памяти, благодаря чему наше тело долго помнит инфекцию и гораздо быстрее реагирует на нее при повторном заражении.
Оба эти типа иммунитета тесно связаны между собой, и многие особенности их работы до сих пор активно изучаются.
Как вакцина формирует приобретенный иммунитет?
При первом заражении инфекцией иммунной системе нужно некоторое время для выработки приобретенного иммунитета. Он работает эффективнее врожденного и может защищать нас на протяжении всей дальнейшей жизни, но формируется такой иммунитет не сразу.
Тот же принцип действует и при вакцинации. Упрощенно выработка приобретенного иммунитета происходит в четыре этапа:
- Индукция. Макрофаги атакуют чужеродные клетки и передают информацию об антигене лимфоцитам.
- Иммунорегуляторный этап. T- и B-лимфоциты нацеливаются на борьбу с инфекционным агентом.
- Эффекторная стадия. Происходит выработка специфических антител и Т-лимфоцитов против инфекции.
- Формирование иммунологической памяти, которая позволяет мгновенно отреагировать на вторжение возбудителя, против которого была сделана прививка.
На формирование защиты при этом уходит около месяца, поэтому прививку от гриппа или клещевого энцефалита делают заранее.
Что скрывается в шприце
Все вакцины можно условно разделить на две группы:
- Корпускулярные вакцины. Они содержат ослабленный живой (вакцины против полиомиелита, кори, свинки, краснухи, туберкулеза) или целый “убитый” (вакцины против коклюша, бешенства, вирусного гепатита А и полиомиелита) микроорганизм (рис. 2 А и Б). В озбудителей инфекций ослабляют, выращивая их в лаборатории на культурах клеток, пока дикий штамм не изменит свойства, став безопасным ровно настолько, чтобы способствовать формированию иммунитета, но не вызывать самого заболевания. Для “убийства” клеток вируса или бактерий чаще всего используют формальдегид. Такие вакцины безопаснее живых, но иммунитет после них менее стойкий.
- Субъединичные вакцины. В состав таких препаратов входят не целые микроорганизмы, а только отдельные компоненты клеточной стенки или других частей возбудителя (вакцины против коклюша, менингококковой инфекции и др.) (рис. 2 В). В эту же группу входят вакцины, содержащие инактивированные токсины бактерий (вакцины против дифтерии и столбняка) и рекомбинантные вакцины. Последние получают методами генной инженерии, когда генетический материал опасного микроорганизма помещают в дрожжи, после чего модифицированные дрожжи производят необходимые для вакцины белки-антигены. Примером могут служить вакцины против вирусного гепатита B и вируса папилломы человека.
А.
Б.
В.
Рисунок 2. Как получают разные виды вакцин. А — Корпускулярные живые ослабленные (аттенуированные) вакцины. Б — Корпускулярные “убитые” (инактивированные) вакцины. В — Субъединичные вакцины. Источник
В то же время, наука не стоит на месте, изобретая все новые подходы к получению вакцин. Например, к препаратам нового поколения относят ДНК-вакцины. В этом случае вакциной служит не белок, который характерен для болезнетворного микроорганизма, а кусочек его ДНК или РНК, вставленный в безопасный вирус или в плазмиду (кольцо из ДНК). После проникновения этой ДНК в клетки организма в них начинает производиться нужный белок-антиген, на который реагирует наша иммунная система. Пока ДНК-вакцинация — очень молодое, но перспективное направление. Специалисты считают, что с ее помощью можно эффективно бороться с раком и множеством опасных инфекций, например, с ВИЧ и гепатитом С.
Помимо основного действующего вещества (бактерий, вирусов или их частей), в состав вакцин могут входить различные консерванты, адъюванты (вещества, усиливающие эффективность вакцины), антибиотики и стабилизаторы.
Как делают прививки
Создать вакцину — это только половина дела. Чтобы вакцинация была эффективна, вакцины нужно вводить аккуратно и в соответствии со специальным графиком. Часто вакцинные препараты требуют очень строгих правил хранения и перевозки, поэтому их бывает трудно доставить в некоторые отдаленные регионы.
Способы вакцинации
Для каждой вакцины определен свой способ введения, чтобы обеспечить быстрое и безопасное действие препарата.
Подкожные и внутримышечные инъекции
Корпускулярные вакцины часто вводят в виде инъекции (укола) внутримышечно, под кожу бедра, плеча или лопатки. Скорость выработки иммунитета при этом средняя. В месте инъекции могут появляться покраснения или уплотнения, которые обычно быстро проходят.
Побочных реакций после введения вакцины в мышцу меньше, а иммунитет вырабатывается быстрее и бывает более крепким.
Пероральный
На язык капают оральную живую вакцину против полиомиелита и некоторых кишечных инфекций. Это просто, быстро и не больно.
Интраназальный
Вакцину от гриппа могут распылять в носу, создавая защиту от воздушно-капельных инфекций.
Почему некоторые прививки нужно делать несколько раз? Ревакцинация
Повторную прививку и ревакцинацию делают для закрепления эффекта, чтобы усилить иммунный ответ и продлить срок его действия. Ревакцинация также помогает расширить поле действия иммунитета при появлении новых штаммов возбудителя (это касается, например, прививок против гриппа).
Почти все вакцины вводятся многократно, для формирования иммунитета может потребоваться до 6 доз (защита от полиомиелита, комплексная вакцинация против дифтерии, коклюша и столбняка). А ревакцинация против гриппа проводится с ежегодной периодичностью.
Что такое национальный календарь прививок?
Сегодня почти во всех странах мира существуют специальные национальные календари прививок. По ним проводится широкая, бесплатная вакцинация для защиты от ряда опасных инфекций.
Российский национальный календарь профилактических прививок предполагает защиту от 12 разных инфекций:
- гепатита B,
- туберкулеза,
- столбняка, коклюша и дифтерии,
- гемофильной инфекции,
- полиомиелита,
- краснухи, кори и эпидемического паротита,
- пневмококковой инфекции,
- гриппа.
Он определяет сроки введения вакцин, устанавливает порядок и периодичность ревакцинации, определяет возраст, в котором должна быть сделана та или иная прививка.
Список прививок может быть расширен для групп риска или в случае угрозы эпидемии (календарь профилактических прививок по эпидемическим показаниям). Некоторые вакцины можно вводить в экстренном порядке, сразу после возможного заражения.
Несмотря на то, что в Календаре основная масса прививок предназначена для детей и подростков, взрослым тоже не следует забывать о своевременной иммунизации. Ревакцинацию против дифтерии и столбняка следует проходить каждые 10 лет, а от гриппа прививаться каждую осень. Если вы планируете беременность или собираетесь в путешествие в экзотическую страну, вам также могут потребоваться дополнительные прививки.
В некоторых развитых странах массово вакцинируют от большего числа инфекций, например, против ротавируса, гепатита А, менингококка и вируса папилломы человека. Опираясь на мнения ведущих мировых экспертов в области вакцинопрофилактики, Союз педиатров России составил собственные расширенные графики вакцинации для детей и подростков.
Что будет, если не делать прививки себе или детям?
То, что было в допрививочную эру, когда взрослые тяжело болели всевозможными инфекциями, а дети тысячами умирали от них. Детские кладбища в европейских и американских городах тогда были обычным делом (рис. 3).
Эпидемии кори, дифтерии и полиомиелита, неоднократно вспыхивавшие после распада СССР благодаря тому, что система обязательной бесплатной вакцинации на постсоветском пространстве была разрушена, лучше всего отвечают на этот вопрос.
Другое последствие — снижение коллективного иммунитета, который ограничивает распространение инфекции только пока большая часть населения (70–80%) вакцинирована против нее.
Иммунизация в России – дело добровольное. Это означает, что родители вправе самостоятельно решать, будут ли они прививать ребенка. Школы и детские сады в нашей стране только при угрозе вспышки инфекции или во время эпидемии могут временно отказать в посещении не привитому ребенку (ФЗ-157 «Об иммунопрофилактике инфекционных болезней»). Роспотребнадзор также рекомендует разобщать не привитых против полиомиелита детей, с теми, кто получил оральную живую полиовакцину, на срок не менее 60 дней (СП 3.1.2951-11 «Профилактика полиомиелита»).
Некоторые страны отказывают во въезде взрослым и детям без прививок. Взрослым могут отказать в трудоустройстве на предприятие, где требуется прохождение медкомиссии.
Насколько прививки безопасны
Всемирная организация здравоохранения называет вакцинацию самым безопасным и действенным способом профилактики опасных инфекций. Поскольку живые ослабленные вакцины очень редко, но все же становятся причиной тяжелых осложнений и даже могут вызывать симптомы заболевания (как оральная живая полиовакцина), от них постепенно отказываются в пользу более современных препаратов, содержащих только антигенные компоненты возбудителей. Они гораздо легче переносятся, а их использование не сопряжено с серьезными побочными эффектами.
Побочные реакции при введении вакцин (покраснение в месте инъекции, повышение температуры, небольшое ухудшение самочувствия) не опасны, быстро проходят и не требуют лечения.
Одно из самых распространенных поствакцинальных осложнений (которые сами по себе крайне редки) — это аллергические реакции. При склонности к ним врач порекомендует принимать антигистаминные препараты за несколько дней до и после прививки. Число других осложнений, требующих лечения, не превышает 1%, причем доля серьезных случаев даже в этом проценте невелика.
Относительно высокой реактогенностью в сравнении с другими вакцинами обладают:
- Живая ослабленная вакцина против кори (часто вводится совместно с препаратами против краснухи и свинки). После коревой вакцины могут возникать судороги (вероятность — 0,025-0,3%), аллергические реакции (вероятность — 0,0001–0,00035%), тромбоцитопения (вероятность — 0,0026%).
- Убитая цельноклеточная вакцина против коклюша (вводится совместно с анатоксинами дифтерии и столбняка). После цельноклеточной коклюшной вакцины могут возникнуть фебрильные судороги (вероятность — 0,022%), развиться гипотензивно-гипореспонсивный синдром (вероятность — 0,067%), детский плач может продолжаться несколько часов (вероятность — 0,4%).
Часто осложнения после вакцин связаны с индивидуальными особенностями здоровья, например, с хроническими заболеваниями или ослабленным иммунитетом. Снизить их риск можно, сдав анализ крови и пройдя осмотр у врача перед прививкой.
Противопоказания
Не следует делать прививки, если у пациента:
- отмечались серьезные аллергические реакции на предыдущие введения данной вакцины,
- есть аллергия к компонентам вакцины (например, к белку куриных яиц),
- пациент находится в острой фазе заболевания,
- есть серьезные хронические заболевания, угнетена иммунная система.
Часто поводом отказаться от вакцинации становится беременность. Подробно обо всех противопоказаниях можно прочитать в инструкции по применению к каждому препарату отдельно. Перед вакцинацией проконсультируйтесь со своим лечащим врачом.
Самые известные мифы о прививках
Вокруг безопасности вакцин всегда было много слухов, и некоторые из них породили очень живучие мифы, несмотря на то, что никаких доказательств их правдивости нет. Интересно, что мифы об опасности вакцин воспринимаются многими людьми серьезнее, чем реальная угроза, исходящая от инфекций. Мы уже забыли, чем страшны корь, коклюш и полиомиелит. Нам кажется, что эти болезни уже не вернутся, а потому мы начинаем бояться прививок сильнее, чем болезней.
Правда ли, что вакцины вызывают аутизм?
Это распространенный миф. В 1998 году в журнале Lancet была опубликована статья о связи между вакциной против кори, краснухи и паротита (свинки) и аутизмом. Позже приведенные в ней данные были признаны недостоверными: часть из них была фальсифицирована автором статьи Эндрю Уэйкфилдом. В 2010 году его лишили врачебной лицензии за нарушение профессиональной этики.
Правда ли, что с помощью вакцины можно чипировать человека?
Чипирование (введение электронного чипа) людей с помощью прививок технически невозможно. Часто в одном флаконе находится несколько доз препарата. Даже если в нем есть микрочипы, невозможно дозировать их, набирая раствор шприцем из флакона. Если в ампуле содержится одна доза вакцины, вводимый с препаратом чип должен иметь размеры меньше диаметра иглы для инъекций. Но в этом случае он может остаться на стенках флакона со следами жидкости, а значит, нет гарантии, что чипирование произойдет. Производство вакцин выполняется под очень строгим контролем, и попадание любых посторонних компонентов в препарат исключено.
Что делать, если меня не прививали в детстве
Если вас не прививали в детстве или вы не знаете свой вакцинальный статус, следует пройти догоняющую вакцинацию. Обратитесь к врачу в любой поликлинике, и он составит вам график прививок.
Что делать, если график вакцинации ребенка нарушен
Придерживайтесь той же стратегии, если график вакцинации вашего ребенка был нарушен из-за временного отвода от прививок или по другой причине. Попросите своего педиатра составить для вас индивидуальный план догоняющей вакцинации, который позволит сформировать полноценную защиту против инфекций.
Заключение
Итак, на сегодняшний день вакцинация остается в числе самых действенных способов защиты от инфекционных болезней. Она проводится добровольно, является безопасной, а связанные с ней риски минимальны. Выполнение прививок по рекомендациям медиков — необходимая мера заботы о здоровье. Не забывайте вовремя проходить ревакцинацию и помните о прививках, собираясь в путешествие.
Источники
- Janeway’s Immunobiology. 9th edition. Kenneth Murphy, Casey Weaver. -GS. -2017.
- Red book. Atlas of pediatric Infectious diseases. Editor: Carol J. Baker, MD, FAAP. American Academy of Pediatrics. -2020.
- Официальный сайт ВОЗ.
- Официальный сайт Центров по контролю и профилактике заболеваний США (CDC).
- Сайт ЯПривит.
- Белых Н.А. Основы вакцинопрофилактики.