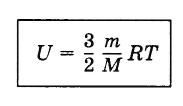На этой странице вы можете рассчитать внутреннюю энергию идеального газа с помощью калькулятора онлайн или самостоятельно по формулам.
Содержание:
- калькулятор внутренней энергии идеального газа
- внутренняя энергия идеального газа через массу, молярную массу и температуру
- внутренняя энергия идеального газа через давление и объем
- внутренняя энергия идеального газа через количество вещества и температуру
- внутренняя энергия идеального газа через степени свободы
- степени свободы идеальных газов
Формула внутренней энергии идеального газа через массу, молярную массу и температуру
{U = dfrac{3}{2} cdot dfrac{m}{M} cdot R T}
U — внутренняя энергия газа
m — масса газа
M — молярная масса газа
R — универсальная газовая постоянная R = 8,314 462 618 153 24 Дж/(моль∙К)
T — абсолютная температура газа
Формула внутренней энергии идеального газа через давление и объем
{U = dfrac{3}{2} cdot p V}
U — внутренняя энергия газа
p — давление газа
V — объем газа
Формула внутренней энергии идеального газа через количество вещества и температуру
{U = dfrac{3}{2} cdot nu RT}
U — внутренняя энергия газа
ν — количество вещества (в молях)
R — универсальная газовая постоянная R = 8,314 462 618 153 24 Дж/(моль∙К)
T — абсолютная температура газа
Формула внутренней энергии идеального газа через степени свободы
{U = dfrac{i}{2} cdot nu RT}
U — внутренняя энергия газа
i — количество степеней свободы
ν — количество вещества (в молях)
R — универсальная газовая постоянная R = 8,314 462 618 153 24 Дж/(моль∙К)
T — абсолютная температура газа
Количество степеней свободы молекулы идеального газа
Число степеней свободы (i) — наименьшее число независимых координат, которое необходимо ввести, чтобы определить положение тела в пространстве.
- для одноатомного газа (гелий, неон, аргон, криптон, ксенон, радон, оганесон и т. д.) i=3;
- для двухатомного газа (водород, азот, кислород, фтор, хлор и т. д.) i=5;
- для трехатомного газа i=6;
- для многоатомного (>3) газа i=6;
Внутренняя энергия идеального одноатомного газа. Определим внутреннюю энергию идеального одноатомного газа, т. е. газа, образованного атомами. Например, одноатомными газами являются инертные газы — гелий, неон, аргон и др.
Из определения понятия «идеальный газ» следует, что его внутренняя энергия является суммой кинетических энергий хаотического движения всех атомов (или молекул) (потенциальная энергия взаимодействия между частицами отсутствует). Следовательно, внутренняя энергия идеального одноатомного газа равна произведению средней кинетической энергии теплового движения частиц на их число
, т. е.
. Поскольку
,
где — масса газа, а
, то
.
С учётом того, что произведение постоянной Больцмана и постоянной Авогадро , где
— универсальная газовая постоянная, получим:
,
(11.1)
или
.
Из формулы (11.1) следует, что внутренняя энергия данной массы идеального одноатомного газа пропорциональна его абсолютной температуре. Она не зависит от других макроскопических параметров состояния — давления и объёма. Следовательно, изменение внутренней энергии данной массы одноатомного идеального газа происходит только при изменении его температуры:
От теории к практике
1. Воздух при комнатной температуре и нормальном атмосферном давлении можно описывать моделью идеального газа. Как показывают расчёты, внутренняя энергия двухатомного газа больше внутренней энергии одинакового количества одноатомного газа, находящегося при такой же температуре, в раза. Учитывая, что воздух состоит в основном из двухатомных молекул, оцените внутреннюю энергию воздуха в комнате, длина которой
, ширина
, высота
.
Сравните полученный результат с кинетической энергией грузового автомобиля массой , движущегося со скоростью, модуль которой
. Сделайте вывод.
2. Идеальный одноатомный газ, количество вещества которого , перевели из состояния 1 в состояние 2 (рис. 64). Как и на сколько изменилась внутренняя энергия газа?
При определении внутренней энергии реальных газов, жидкостей и твёрдых тел необходимо учитывать потенциальную энергию взаимодействия частиц, которая зависит от расстояния между ними. Поэтому в общем случае внутренняя энергия макроскопических тел зависит не только от абсолютной температуры, но и от объёма.
Изменить внутреннюю энергию термодинамической системы можно двумя способами: используя теплообмен и совершая работу. Процесс теплообмена и совершение работы характеризуют соответственно физическими величинами — количеством теплоты Q и работой А, которые являются мерами изменения внутренней энергии системы.
1. Что называют термодинамической системой?
2. Что понимают под внутренней энергией макроскопического тела? Термодинамической системы?
3. Что представляет собой внутренняя энергия идеального газа? От чего зависит её значение?
5. От каких параметров зависят значения внутренней энергии идеального газа и внутренней энергии реальных газов?
При
изучении тепловых явлений наряду с
механической энергией тел вводится
новый вид энергии —
внутренняя
энергия. Вычислить внутреннюю энергию
идеального газа не составляет большого
труда.
Наиболее
прост по своим свойствам одноатомный
газ, т. е. газ, состоящий из отдельных
атомов, а не молекул. Одноатомными
являются инертные газы — гелий, неон,
аргон и др. Можно получить одноатомный
(атомарный) водород, кислород и т. д.
Однако такие газы будут неустойчивыми,
так как при столкновениях атомов
образуются молекулы Н2,
О2
и др.
Молекулы
идеального газа не взаимодействуют
друг с другом, кроме моментов
непосредственного столкновения. Поэтому
их средняя потенциальная энергия очень
мала и вся
энергия представляет собой кинетическую
энергию хаотического движения молекул.
Это,
конечно, справедливо, если сосуд с газом
покоится, т. е. газ как целое не движется
(его центр масс находится в покое). В
этом случае упорядоченное движение
отсутствует и механическая энергия
газа равна нулю. Газ обладает энергией,
которую называют внутренней.
Для
вычисления внутренней энергии идеального
одноатомного газа массой т
нужно
умножить среднюю энергию одного атома,
выражаемую формулой (4.5.5), на число
атомов. Это число равно произведению
количества вещества
на
постоянную Авогадро NA.
Умножая
выражение (4.5.5) на
,
получим
внутреннюю энергию идеального одноатомного
газа:
(4.8.1)
Внутренняя
энергия идеального газа прямо
пропорциональна его абсолютной
температуре. От
объема газа она не зависит. Внутренняя
энергия газа представляет собой среднюю
кинетическую энергию всех его атомов.
Если
центр масс газа движется со скоростью
v0,
то
полная энергия газа равна сумме
механической (кинетической) энергии
и внутренней энергииU:
(4.8.2)
Внутренняя энергия молекулярных газов
Внутренняя энергия
одноатомного газа (4.8.1) — это по существу
средняя кинетическая энергия
поступательного движения молекул. В
отличие от атомов молекулы, лишенные
сферической симметрии, могут еще
вращаться. Поэтому наряду с кинетической
энергией поступательного движения
молекулы обладают и кинетической
энергией вращательного движения.
В
классической молекулярно-кинетической
теории атомы и молекулы рассматриваются
как очень маленькие абсолютно твердые
тела. Любое тело в классической механике
характеризуется определенным числом
степеней свободы
f
— числом независимых переменных
(координат), однозначно определяющих
положение тела в пространстве.
Соответственно число независимых
движений, которые тело может совершать,
также равно f.
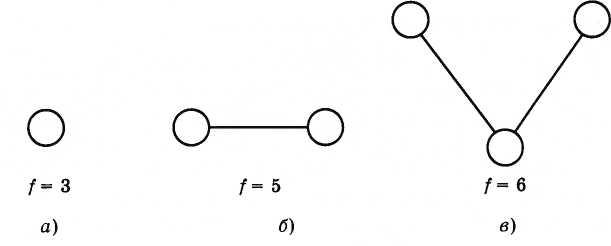
Атом
можно рассматривать как однородный
шарик с числом степеней свободы f
=
3 (рис. 4.16, а). Атом может совершать только
поступательное движение по трем
независимым взаимно перпендикулярным
направлениям. Двухатомная молекула
обладает осевой симметрией (рис. 4.16, б)
и
имеет пять степеней свободы. Три степени
свободы соответствуют ее поступательному
движению и две — вращательному вокруг
двух осей, перпендикулярных друг другу
и оси симметрии (линии, соединяющей
центры атомов в молекуле). Многоатомная
молекула, подобно, твердому телу
произвольной формы, характеризуется
шестью степенями свободы (рис. 4.16, в);
наряду
с поступательным движением молекула
может совершать вращения вокруг трех
взаимно перпендикулярных осей.
Рис. 4.16
От числа степеней
свободы молекул зависит внутренняя
энергия газа. Вследствие полной
беспорядочности теплового движения ни
один из видов движения молекулы не имеет
преимущества перед другим. На каждую
степень свободы, соответствующую
поступательному или вращательному
движению молекул, приходится одна и та
же средняя кинетическая энергия. В этом
состоит теорема о равномерном распределении
кинетической энергии по степеням свободы
(она строго доказывается в статистической
механике).
Средняя
кинетическая энергия поступательного
движения молекул равна
.
Поступательному
движению соответствуют три степени
свободы. Следовательно, средняя
кинетическая энергия
,
приходящаяся на одну степень свободы,
равна:
(4.8.3)
Если
эту величину умножить на число степеней
свободы и число молекул газа массой т,
то
получится внутренняя энергия произвольного
идеального газа:
(4.8.4)
Эта
формула отличается от формулы (4.8.1) для
одноатомного газа заменой множителя 3
на множитель f.
Внутренняя
энергия идеального газа прямо
пропорциональна абсолютной температуре
и не зависит от объема газа.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Прежде чем приступить к изучению нового материала, давайте с
вами вспомним, чем мы занимались при изучении молекулярно-кинетической теории.
Там наша основная задача заключалась в установлении связи между
макроскопическими параметрами, характеризующими состояние системы, и её микроскопическими
параметрами. Это позволило нам объяснить, почему газ оказывает давление на
стенки сосуда, что такое температура и так далее.
Также мы с вами вывели уравнение состояния идеального газа. Удалось
нам это сделать только потому, что мы рассматривали самую простую систему —
идеальный газ. Напомним, что в идеальном газе отсутствуют взаимодействия между
молекулами, и поэтому нам не нужно было учитывать потенциальную энергию их взаимодействия.
Однако, если бы мы попытались построить молекулярно-кинетическую теорию
реального газа (не говоря уже о жидкостях и твёрдых телах), то всё было бы
гораздо сложнее, а порой и почти невозможно.
Но существует ещё один раздел молекулярной физики, который
пытается установить соответствия между макроскопическими параметрами, абсолютно
не интересуясь, как устроена система (то есть без учёта молекулярного строения
тел). Этот раздел физики называется термодинамикой.
Интересно, что первой научной теорией тепловых процессов была
не молекулярная физика, а именно термодинамика. Считается, что она берёт своё
начало с работы Сади Карно «О движущей силе огня и о машинах, способных
развивать эту силу», опубликованной в 1824 году.
А становление термодинамики как науки началось примерно в
40-х годах XIX века после того, как Юлиус Майер, Герман
Гельмгольц и Джеймс Джоуль количественно определили связь между механической
работой и теплотой и сформулировали универсальный закон сохранения и
превращения энергии.
Выводы термодинамики основаны на фундаментальных законах,
называемых началами термодинамики. Это не теоретические законы. Все они
были установлены в результате обобщения многочисленных экспериментальных
фактов.
Все физические тела и их модели в термодинамике мы будем
называть термодинамическими системами. При этом для каждой
изолированной термодинамической системы существует состояние термодинамического
равновесия, в которое она переходит самопроизвольно. Это утверждение называют нулевым
началом термодинамики.
Основным понятием в термодинамике является понятие внутренней
энергии, о которой мы говорили ещё в восьмом классе. Давайте с вами
вспомним, что под внутренней энергией тела (или системы тел) понимают сумму
кинетической энергии хаотического теплового движения молекул и потенциальной
энергии их взаимодействия.
Обозначают внутреннюю энергию большой латинской буквой U. А измеряют её в тех же единицах, что и механическую
энергию, то есть в джоулях.
[U] = [Дж].
Теперь давайте с вами вспомним, от каких величин зависит
внутренняя энергия тела или системы тел. Мы уже с вами знаем, что чем выше
температура тела, тем быстрее движутся его молекулы и тем больше их
кинетическая энергия. Значит, внутренняя энергия тела зависит от его
температуры.
Также нам известно, что для перевода вещества, например, из
жидкого состояния в газообразное, нужно к веществу подвести энергию.
Следовательно, пар будет обладать большей внутренней энергией, чем жидкость той
же массы. Значит, внутренняя энергия тела при неизменной массе зависит от
его агрегатного состояния.
Ну а так как масса тела равна сумме масс составляющих его
частиц, то внутренняя энергия зависит и от массы тела.
Но внутренняя энергия тела не зависит от его механического
движения и от его взаимодействия с другими телами. Так, например, внутренняя
энергия мяча, лежащего на полу и поднятого на некоторую высоту от пола,
одинакова, так же как и мяча, неподвижного и катящегося по полу (если, конечно,
пренебречь силами сопротивления его движению).
Рассчитать внутреннюю энергию можно только для идеального
газа. Давайте с вами определим внутреннюю энергию идеального одноатомного газа,
то есть газа, состоящего из отдельных атомов (к такому газу относятся инертные
газы — гелий, неон, аргон и так далее).
Итак, согласно модели идеального газа, его молекулы не
взаимодействуют друг с другом. Поэтому внутренней энергией такого газа является
сумма кинетических энергий хаотического движения всех его молекул или атомов.
Следовательно, внутренняя энергия идеального одноатомного газа равна
произведению средней кинетической энергии теплового движения молекул на их
число:
Число молекул в данной порции газа мы можем легко выразить из
определения количества вещества:
А значение средней кинетической энергии поступательного
движения молекул мы распишем через постоянную Больцмана и абсолютную
температуру:
Перепишем формулу для внутренней энергии с учётом последних
двух формул:
Теперь давайте с вами вспомним, что произведение постоянной
Больцмана и числа Авогадро — это есть универсальная газовая постоянная R. Тогда получаем, что внутренняя энергия идеального
одноатомного газа прямо пропорциональна его абсолютной температуре и не зависит
от других макроскопических параметров системы:
Для примера давайте с вами определим внутреннюю энергию неона
массой 5 г, находящегося при температуре 27 оС.
Как правило, значение внутренней энергии в большинстве
случаев вычислить очень трудно, поскольку каждое тело состоит из огромного
числа частиц. Однако нас чаще будет интересовать не само значение внутренней
энергии, а её изменение, которое происходит при переходе системы из одного
состояния в другое.
Под приращением (или изменением) внутренней энергии
понимают разность внутренних энергий системы в конечном и начальном состояниях:
∆U = U2
– U1.
Например, переход некоторой массы идеального газа из
состояния один в состояние три можно осуществить или в ходе изохорного
нагревания и последующим изобарным расширением, или при изобарном расширении, а
затем при изохорном нагревании. Однако изменение внутренней энергии газа и в одном
и в другом случае будет одинаковым:
∆U123
= ∆U143 = U3 – U1.
Иными словами, внутренняя энергия является функцией состояния
системы. Это означает, что изменение внутренней энергии при переходе
термодинамической системы из одного состояния в другое зависит только лишь от
значений параметров этих состояний, а не от процесса перехода.
В частности, изменение внутренней энергии данной масса идеального
одноатомного газа происходит только при изменении его температуры:
В качестве примера решим такую задачу. На рисунке в
координатах (p, V) изображён процесс перехода идеального одноатомного
газа определённой массы из состояния 1 в состояние 2. Определите приращение
внутренней энергии газа, если его давление в конечном состоянии составляет 2
МПа, а объём в начальном состоянии был равен 3,0 л.
В заключении урока отметим, что при определении внутренней
энергии реальных газов, жидкостей и твёрдых тел необходимо ещё учитывать и потенциальную
энергию взаимодействия частиц, которая зависит от расстояния между ними.
Поэтому в общем случае внутренняя энергия макроскопических тел зависит не
только от абсолютной температуры, но и от объёма.
При изучении физики в восьмом классе вы узнали, что изменить
состояние термодинамической системы можно двумя способами: используя
теплопередачу или совершая работу. Процесс теплопередачи и совершение работы
характеризуют соответственно физическими величинами — количеством теплоты Q и работой А, которые являются мерами изменения
внутренней энергии системы.
Числом степеней свободы механической системы называют количество независимых величин, с помощью которых может быть задано положение системы.
Внутренняя энергия идеального газа представляет собой сумму только кинетической энергии всех молекул, а потенциальной энергией взаимодействия можно пренебречь:
U=∑Ek0=NEk0=mNAM·ikT2=i2·mMRT=i2νRT=i2pV
i — степень свободы. i = 3 для одноатомного (или идеального) газа, i = 5 для двухатомного газа, i = 6 для трехатомного газа и больше.
Изменение внутренней энергии идеального газа в изопроцессах
| Основная формула |
ΔU=32·mMRT=32νRT=32νR(T2−T1) |
| Изотермический процесс |
ΔU=0 Температура при изотермическом процессе — величина постоянная. Так как внутренняя энергия идеального газа постоянной массы в замкнутой системе зависит только от изменения температуры, то она тоже остается постоянной. |
| Изобарное расширение |
ΔU=32νR(T2−T1)=32(pV2−pV1)=32pΔV |
| Изохорное увеличение давления |
ΔU=32νR(T2−T1)=32(p2V−p1V)=32VΔp |
| Произвольный процесс |
ΔU=32νR(T2−T1)=32(p2V2−p1V1) |
Пример №1. На рисунке показан график циклического процесса, проведенного с идеальным газом. На каком из участков внутренняя энергия газа уменьшалась?
Внутренняя энергия газа меняется только при изменении температуры. Так как она прямо пропорциональная температуре, то уменьшается она тогда, когда уменьшается и температура. Температура падает на участке 3.
Работа идеального газа
Если газ, находящийся под поршнем, нагреть, то, расширяясь, он поднимет поршень, т.е. совершит механическую работу.
Механическая работа вычисляется по формуле:
A=Fscosα
Перемещение равно разности высот поршня в конечном и начальном положении:
s=h2−h1
Также известно, что сила равна произведению давления на площадь, на которое это давление оказывается. Учтем, что направление силы и перемещения совпадают. Поэтому косинус будет равен единице. Отсюда работа идеального газа равна произведению давления на площадь поршня:
Работа идеального газа
F=pS
p — давление газа, S — площадь поршня
Работа, необходимая для поднятия поршня — полезная работа. Она всегда меньше затраченной работы, которая определяется изменением внутренней энергии идеального газа при изобарном расширении:
A‘=p(V2−V1)=pΔV>0
Внимание! Знак работы определяется только знаком косинуса угла между направлением силы, действующей на поршень, и перемещением этого поршня.
Работа идеального газа при изобарном сжатии:
A‘=p(V2−V1)=pΔV<0
Работа идеального газа при нагревании газа:
A‘=νRΔT=νR(T2−T1)=mMνRΔT
Внимание! В изохорном процессе работа, совершаемая газом, равна нулю, так как работа газа определяется изменением его объема. Если изменения нет, работы тоже нет.
Геометрический смысл работы в термодинамике
В термодинамике для нахождения работы можно вычислить площадь фигуры под графиком в осях (p, V).
Примеры графических задач
| Изобарное расширение:
A‘=p(V2−V1) A‘>0 |
 |
| Изобарное сжатие:
A‘=p(V2−V1) A‘<0 |
 |
| Изохорное охлаждение:
V=const A‘=0 |
 |
|
Изохорное охлаждение и изобарное сжатие: 1–2: A‘=0 2–3: A‘=pΔV<0 |
 |
| Замкнутый цикл:
1–2: A‘>0 2–3: A‘=0 3–4: A‘<0 4–1: A‘=0 A‘=(p1−p3)(V2−V1) |
 |
| Произвольный процесс:
A‘=p1+p22(V2−V1) |
 |
Пример №2. На pV-диаграмме показаны два процесса, проведенные с одним и тем же количеством газообразного неона. Определите отношение работ A2 к A1 в этих процессах.
Неон — идеальный газ. Поэтому мы можем применять формулы, применяемые для нахождения работы идеального газа. Работа равна площади фигуры под графиком. С учетом того, что в обоих случаях изобарное расширение, получим:
A2=p(V2−V1)=4p(5V−3V)=4p2V=8pV
A1=p(V2−V1)=p(5V−V)=4pV
Видно, что работа, совершенная во втором процессе, вдвое больше работы, совершенной газом в первом процессе.
Задание EF17505

Для каждой величины подберите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
- Определить по графику, как меняется давление.
- Определить, как меняется объем.
- Определить, отчего зависит внутренняя энергия газа, и как она меняется в данном процессе.
Решение
На графике идеальный одноатомный газ изотермически сжимают, так как температура остается неизменной, а давление увеличивается. При этом объем должен уменьшаться. Но внутренняя энергия идеального газа определяется его температурой. Так как температура постоянна, внутренняя энергия не изменяется.
Ответ: 123
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17758
Один моль аргона, находящийся в цилиндре при температуре T1=600 K и давлении p1=4⋅105 Па, расширяется и одновременно охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа p2=105 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
Алгоритм решения
1.Записать исходные данные.
2.Записать уравнение состояния идеального газа.
3.Записать формулу для расчета внутренней энергии газа.
4.Используя первое начало термодинамики, выполнить общее решение задачи.
5.Подставив известные данные, вычислить неизвестную величину.
Решение
Запишем исходные данные:
• Начальная температура газа: T1 = 600 К.
• Начальное давление: p1 = 4∙105 Па.
• Конечное давление: p2 = 105 Па.
• Работа, совершенная газом: A = 2493 Дж.
Аргон является одноатомным газом. Поэтому для него можно использовать уравнение состояния идеального газа:
pV=νRT
Внутренняя энергия одноатомного идеального газа пропорциональна температуре:
U=32νRT
Внутренняя энергия аргона до расширения и после него:
U1=32νRT1
U2=32νRT2
Согласно условию задачи, температура при расширении обратно пропорциональна объёму. Следовательно:
T=constV
T1V1=T2V2
Выразим конечную температуру:
T2=T1V1V2
Составим уравнение состояния газа для состояний аргона 1 и 2:
p1V1=νRT1
p2V2=νRT2
Отсюда:
νR=p1V1T1=p2V2T2
Отсюда отношение объема аргона в состоянии 1 к объему газа в состоянии 2 равно:
V1V2=p2T1p1T2
Подставим это отношение в формулу для конечной температуры:
T2=T1V1V2=p2T12p1T2
Отсюда:
T2=T1√p2p1
Отсюда внутренняя энергия газа в состоянии 2 равна:
U2=32νRT1√p2p1
Уменьшение внутренней энергии аргона составило (изначально она была выше):
ΔU=U1−U2=32νRT1−32νRT1√p2p1=32νRT1(1−√p2p1)
В соответствии с первым началом термодинамики уменьшение внутренней энергии равно сумме совершённой работы и количества теплоты, отданного газом:
ΔU=Q+A
Следовательно, газ отдал следующее количество теплоты:
Q=ΔU−A=32νRT1(1−√p2p1)−A
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17966
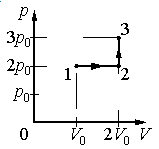
Ответ:
а) р0V0
б) 2р0V0
в) 4р0V0
г) 6р0V0
Алгоритм решения
1.Определить, на каком участке графика совершается работа.
2.Записать геометрический смысл работы.
3.Извлекая данные из графика, вычислить работу, совершенную газом.
Решение
Работа совершается только тогда, когда газ меняет объем. Поэтому работа совершается только на участке 1–2.
Работа идеального газа равна площади фигуры, заключенной под графиком термодинамического процесса в координатах (p, V).
Давление газа при этом равно 2p0, а объем равен разности 2V0 и V0. Следовательно, работа, совершенная газом, будет равна произведению:
A=2p0(2V0−V0)=2p0V0
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 15.1k