Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Основные положения метода молекулярных орбиталей
Электронное строение гомоядерных двухатомных молекул и ионов
Электронное строение гетероядерных молекул и ионов
Задачи для самостоятельного решения
Основные положения метода молекулярных орбиталей (МО ЛКАО)
- В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) – связывающую, энергия которой ниже, чем энергия АО, и разрыхляющую, энергия которой выше энергии АО.
- Электроны в молекуле располагаются на молекулярных орбиталях в соответствии с принципом Паули и правилом Хунда.
- Отрицательный вклад в энергию химической связи электрона, находящегося на разрыхляющей орбитали больше, чем положительный вклад в эту энергию электрона на связывающей МО.
- Кратность связи в молекуле равна деленной на два разности числа электронов, находящихся на связывающих и разрыхляющих МО.
- С повышением кратности связи в однотипных молекулах увеличивается ее энергия связи и уменьшается ее длина.
Если при образовании молекулы из атомов электрон займет связывающую МО, то полная энергия системы понизится, т.е. образуется химическая связь. При переходе электрона на разрыхляющую МО энергия системы повысится, система станет менее устойчивой (рис. 1).
Рис. 1. Энергетическая диаграмма образования молекулярных орбиталей из двух атомных орбиталей.
Молекулярные орбитали, образованные из s-атомных орбиталей, обозначаются ss. Если МО образованы рz-атомными орбиталями – они обозначаются s z. Молекулярные орбитали, образованные рx— и рy-атомными орбиталями, обозначаются π x и π y соответственно.
При заполнении молекулярных орбиталей электронами следует руководствоваться следующими принципами:
- Каждой МО отвечает определенная энергия. Молекулярные орбитали заполняются в порядке увеличения энергии.
- На одной молекулярной орбитали может находиться не более двух электронов с противоположными спинами.
- Заполнение молекулярных квантовых ячеек происходит в соответствии с правилом Хунда.
Экспериментальное исследование (изучение молекулярных спектров) показало, что энергия молекулярных орбиталей возрастает в следующей последовательности:
σ 1s < σ *1s < σ 2s <σ *2s < σ 2pz < π 2рх = π 2ру < π *2рх = π *2ру < σ *2pz.
Звездочкой (*) в этом ряду отмечены разрыхляющие молекулярные орбитали.
У атомов В, С и N энергии 2s- и 2p-электронов близки и переход 2s-электрона на молекулярную орбиталь σ 2pz требует затраты энергии. Следовательно, для молекул В2, С2, N2 энергия орбитали σ 2pz становится выше энергии орбиталей π 2рх и π 2ру:
σ 1s < σ *1s < σ 2s <σ *2s < π 2px = π 2ру < σ 2pz <π *2рх = π *2ру < σ *2pz.
При образовании молекулы электроны располагаются на орбиталях с более низкой энергией. При построении МО обычно ограничиваются использованием валентных АО (орбиталей внешнего слоя), так как именно они вносят основной вклад в образование химической связи.
Электронное строение гомоядерных двухатомных молекул и ионов
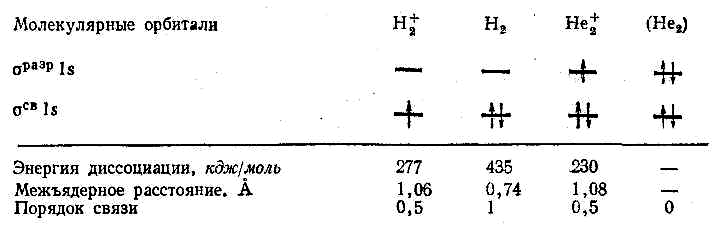
Процесс образования частицы H2+ можно представить следующим образом:
Н[1s] + Н+ → H2+[σ 1s].
Таким образом, на связывающей молекулярной σ -орбитали располагается один электрон.
Кратность связи равна полуразности числа электронов на связывающих и разрыхляющих орбиталях. Значит, кратность связи в частице H2+ равна (1 – 0):2 = 0,5. Метод ВС, в отличие от метода МО, не объясняет возможность образования связи одним электроном.
Молекула водорода имеет следующую электронную конфигурацию:
H2 [(σ 1s)2]
В молекуле H2 имеется два связывающих электрона, значит, связь в молекуле одинарная.
Молекулярный ион H2— имеет электронную конфигурацию:
H2— [(σ 1s)2(σ *1s)1]
Кратность связи в H2— составляет (2 – 1):2 = 0,5.
Рассмотрим теперь гомоядерные молекулы и ионы второго периода.
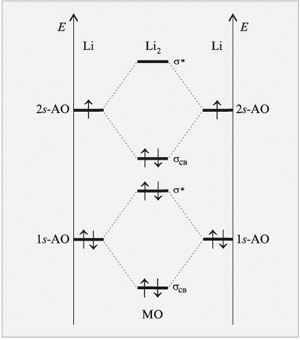
Электронная конфигурация молекулы Li2 следующая:
2Li (K2s) Li2 [KK*(σ 2s)2]
Молекула Li2 содержит два связывающих электрона, что соответствует одинарной связи.
Процесс образования молекулы Ве2 можно представить следующим образом:
2 Ве(K2s2) Ве2 [KK*(σ 2s)2 (σ *2s)2]
Число связывающих и разрыхляющих электронов в молекуле Ве2 одинаково, а поскольку один разрыхляющий электрон уничтожает действие одного связывающего, то молекула Ве2 в основном состоянии не обнаружена.
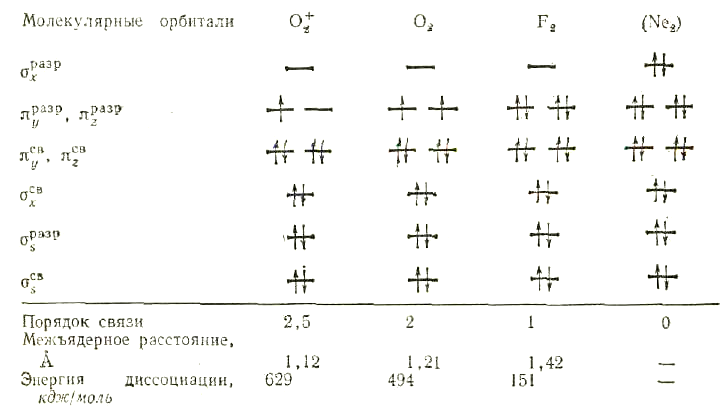
В молекуле азота на орбиталях располагаются 10 валентных электронов. Электронное строение молекулы N2:
N2 [KK*(σ 2s)2 (π *2s)2 (π2px)2 (π2py)2 (σ 2pz)2]
Поскольку в молекуле N2 восемь связывающих и два разрыхляющих электрона, то в данной молекуле имеется тройная связь. Молекула азота обладает диамагнитными свойствами, поскольку не содержит неспаренных электронов.
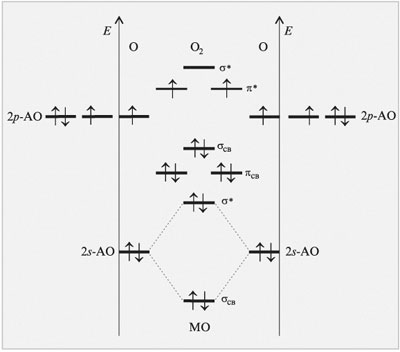
На орбиталях молекулы O2 распределены 12 валентных электронов, следовательно, эта молекула имеет конфигурацию:
O2 [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)1 (π*2py)1]
Рис. 2. Схема образования молекулярных орбиталей в молекуле О2 (показаны только 2р-электроны атомов кислорода)
В молекуле O2, в соответствии с правилом Хунда, два электрона с параллельными спинами размещаются по одному на двух орбиталях с одинаковой энергией (рис. 2). Молекула кислорода по методу ВС не имеет неспаренных электронов и должна обладать диамагнитными свойствами, что не согласуется с экспериментальными данными. Метод молекулярных орбиталей подтверждает парамагнитные свойства кислорода, которые обусловлены наличием в молекуле кислорода двух неспаренных электронов. Кратность связи в молекуле кислорода равна (8–4):2 = 2.
Рассмотрим электронное строение ионов O2+ и O2— . В ионе O2+ на его орбиталях размещаются 11 электронов, следовательно, конфигурация иона следующая:
O2+ [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)1]
или
O2+ [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2py)1]
Кратность связи в ионе О2+ равна (8–3):2 = 2,5. В ионе O2— на его орбиталях распределены 13 электронов. Этот ион имеет следующее строение:
O2— [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)2 (π*2py)1]
или
O2— [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)1 (π*2py)2]
Кратность связи в ионе О2— равна (8 – 5):2 = 1,5. Ионы О2— и О2+ являются парамагнитными, так как содержат неспаренные электроны.
Электронная конфигурация молекулы F2 имеет вид:
F2 [KK(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)2 (π*2py)2]
Кратность связи в молекуле F2 равна 1, так как имеется избыток двух связывающих электронов. Поскольку в молекуле нет неспаренных электронов, она диамагнитна.
В ряду N2, O2, F2 энергии и длины связей в молекулах составляют:
| Молекула | N2 | O2 | F2 |
| Избыток связывающих электронов | 6 | 4 | 2 |
| Энергия связи, кДж/моль | 941 | 494 | 155 |
| Длина связи, пм | 110 | 121 | 142 |
Увеличение избытка связывающих электронов приводит к росту энергии связи (прочности связи). При переходе от N2 к F2 длина связи возрастает, что обусловлено ослаблением связи.
В ряду О2— , О2, О2+ кратность связи увеличивается, энергия связи также повышается, длина связи уменьшается.
Электронное строение гетероядерных молекул и ионов
Изоэлектронными частицами называют частицы, содержащие одинаковое число электронов. Например, к изоэлектронным частицам относятся N2, CO, BF, NO+, CN- .
Согласно методу МО электронное строение молекулы СО аналогично строению молекулы N2:
CO [KK*(σ 2s)2 (σ *2s)2 (π2px)2 (π2py)2 (σ2pz)2]
На орбиталях молекулы СО располагаются 10 электронов (4 валентных электрона атома углерода и 6 валентных электронов атома кислорода). В молекуле СО, как и в молекуле N2, связь тройная. Сходство в электронном строении молекул N2 и СО обуславливает близость физических свойств этих веществ.
В молекуле NO на орбиталях распределены 11 электронов (5 электронов атома азота и 6 электронов атома кислорода), следовательно, электронная конфигурация молекулы такова:
NO [KK*(σ 2s)2 (σ *2s)2 (π2px)2 (π2py)2 (σ 2pz)2 (π*2px)1] или
NO [KK*(σ 2s)2 (σ *2s)2 (π2px)2 (π2py)2 (σ 2pz)2 (π*2py)1]
Кратность связи в молекуле NO равна (8–3):2 = 2,5.
Конфигурация молекулярных орбиталей в ионе NO— :
NO— [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2 (π*2px)1(π*2py)1]
Кратность связи в этой молекуле равна (8–4):2 = 2.
Ион NO+ имеет следующее электронное строение:
NO+ [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2]
Избыток связывающих электронов в этой частице равен 6, следовательно, кратность связи в ионе NO+ равна трём.
В ряду NO— , NO, NO+ избыток связывающих электронов увеличивается, что приводит к возрастанию прочности связи и уменьшению её длины.
Задачи для самостоятельного решения
1. Используя метод МО, установите порядок уменьшения энергии химической связи в частицах:
NF+; NF —; NF.
2. Используя метод МО, установите порядок увеличения энергии химической связи в частицах:
CO—; CO; CO+.
3. На основе метода МО установите, какие из перечисленных частиц не существуют:
He2; He2+; Be2; Be2+.
4. Распределите электроны на молекулярных орбиталях для молекулы B2. Определите кратность связи.
5. Распределите электроны на молекулярных орбиталях для молекулы N2. Определите кратность связи.
6. Используя метод МО, определите кратность связи в молекуле С2.
|
Электроны располагаются на молекулярных орбиталях следующим образом: |
7. На основе метода МО объясните, почему не существует молекулы Ne2.
|
Электроны располагаются на молекулярных орбиталях следующим образом: |
8. Объясните уменьшение энергии связи при переходе от нейтральной молекулы N2 к иону N2—.
|
Электроны располагаются на молекулярных орбиталях следующим образом: |
9. Распределите электроны на молекулярных орбиталях для иона CN—. Определите кратность связи в этом ионе.
|
CN— [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2]. |
10. Используя метод МО определите, как изменяется длина связи и энергия связи в ряду CN+, CN, CN—.
|
Электроны располагаются на молекулярных орбиталях следующим образом: CN+ [KK*(σ2s)2 (σ*2s2 (π2px)2 (π2py)2 ]; CN [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)1]; CN— [KK*(σ2s) 2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2 ]. Избыток связывающих электронов в CN+, CN, CN— соответственно составляет 4, 5, 6. |
…
Мы уже знаем, что в атомах электроны находятся на разрешенных энергетических состояниях – атомных орбиталях (АО). Аналогичным образом, электроны в молекулах существуют в разрешенных энергетических состояниях – молекулярных орбиталях (МО).
Молекулярная орбиталь
Молекулярная орбиталь устроена намного сложнее атомной орбитали. Приведем несколько правил, которыми мы будем руководствоваться при построении МО из АО:
- При составлении МО из набора атомных орбиталей, получается такое же число МО, сколько АО в данном наборе.
- Средняя энергия МО, полученных из нескольких АО, примерно равна (но может быть больше или меньшее) средней энергии взятых АО.
- МО подчиняются принципу запрета Паули: на каждой МО не может находиться более двух электронов, которые должны иметь противоположные спины.
- АО, которые обладают сопоставимой энергией, комбинируются наиболее эффективно.
- Эффективность, с которой комбинируют две атомные орбитали, пропорциональна их перекрыванию друг с другом.
- При образовании МО при перекрывании двух неэквивалентных АО связывающая МО содержит больший вклад АО с наиболее низкой энергией, а разрыхляющая орбиталь – вклад АО с более высокой энергией.
Введем понятие порядок связи. В двухатомных молекулах, порядок связи показывает насколько число связывающих электронных пар превышает число разрыхляющих электронных пар:
Теперь на примерах рассмотрим как строить молекулярные орбитали с применением этих правил.
Молекулярно-орбитальные диаграммы элементов первого периода
Диаграмма МО молекулы Н2
Пример образования молекулы водорода из двух атомов водорода.
В результате взаимодействия 1s-орбиталей каждого из атомов водорода, образуются две молекулярные орбитали.
При взаимодействии, когда электронная плотность концентрируется в пространстве между ядрами, образуется связывающая сигма – орбиталь (σ). Эта комбинация имеет более низкую энергию, чем исходные атомы. При взаимодействии, когда электронная плотность концентрируется за пределами межъядерной области, образуется разрыхляющая сигма – орбиталь (σ*). Эта комбинация имеет более высокую энергию, чем исходные атомы.
Электроны, в соответствии с принципом Паули, занимают сначала орбиталь с самой низкой энергией σ-орбиталь.
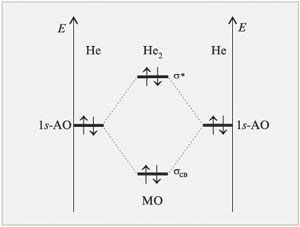
Диаграмма МО молекулы Не2
Теперь рассмотрим пример образования молекулы гелия He2, при сближении двух атомов гелия. В этом случае тоже происходит взаимодействие 1s-орбиталей и образование и σ*-орбиталей, при этом два электрона занимают связывающую орбиталь, а другие два электрона – разрыхляющую.
σ *— орбиталь дестабилизирована в такой же мере, насколько стабилизирована σ –орбиталь, поэтому два электрона, занимающие σ*— орбиталь, дестабилизируют молекулу He2. Действительно, экспериментально доказано, что молекула He2 очень неустойчива.
Как узнать несколько велика прочность молекулы? Чем больше разница в заполненности связывающей и разрыхляющей орбиталей, тем молекула более прочная. Как видно из диаграммы разница в заполненности орбиталей молекулы водорода больше, чем молекулы гелия, поэтому молекула водорода намного более прочная, чем молекула гелия.
Молекулярно-орбитальные диаграммы элементов второго периода
Рассмотрим, как взаимодействуют два одинаковых атома второго периода между собой, имеющие набор из s- и p-орбиталей. Следует ожидать, что 2s-орбитали будут соединяться только друг с другом, а 2p-орбитали – только с а 2p-орбиталями.
Т.к. 2p-орбитали могут взаимодействовать друг с другом двумя различными способами, то образуют σ- и π-молекулярные орбитали. Пользуясь обобщенной диаграммой, показанной ниже, можно установить электронные конфигурации двухатомных молекул второго периода, которые приведены в таблице.
Так, образование молекулы, например, фтора F2 из атомов в системе обозначений теории молекулярных орбиталей может быть записано следующим образом:
2F [1s22s22p5] =F2[(σ1s)2(σ*1s)2(σ2s)2(σ*2s)2(σ2px)2(π2py)2(π2pz)2(π*2py)2(π*2pz)2].
Т.к. перекрывание 1s-облаков незначительно, то участием электронов на этих орбиталях можно пренебречь. Тогда электронная конфигурация молекулы фтора будет такой:
F2[KK(σs)2(σ*s)2(σx)2(πy)2(πz)2(π*y)2(π*z)2],
где К — электронная конфигурация К-слоя.
В таблице приведены молекулярные орбитали двухатомных молекул элементов второго периода бора (B2), углерода (C2), азота (N2), кислорода (O2), фтора (F2)
Рассмотрим подробнее пример образования молекулы лития Li2, принимая во внимание, что 1s- и 2s-орбитали слишком сильно отличаются по энергии и поэтому между ними не возникает сильного взаимодействия.
Диаграмма энергетических уровней молекулы Li2 показана ниже, где электроны, находящиеся на 1s-связывающих и 1s-разрыхляющих орбиталях не вносят значительного вклада в связывание. Поэтому за образование химической связи в молекуле Li2 отвечают 2s-электроны.
Это действие распространяется и на образование других молекул, в которых заполненные атомные подоболочки (s, p, d) не дают вклада в химическую связь. Таким образом, рассматриваются только валентные электроны.
В итоге, для щелочных металлов, молекулярно-орбитальная диаграмма будет иметь вид подобный рассмотренной нами диаграмме молекулы Li2.
Порядок связи n в молекуле Li2 равен 1
Молекулярные орбитали полярных двухатомных молекул
Учение о МО позволяет объяснить и образование двухатомных гетероядерных молекул. Если атомы в молекуле не слишком отличаются друг от друга (например, NO, CO, CN), то можно воспользоваться диаграммой, приведенной выше для элементов 2 периода.
При значительных различиях между атомами, входящих в состав молекулы, диаграмма видоизменяется.
Чем больше электроотрицательность атома, тем более низко на диаграмме обозначают атомные орбитали.
Диаграмма МО молекулы HF
Рассмотрим молекулу HF, в которой атомы сильно отличаются по электроотрицательности.
Энергия 1s-орбитали атома водорода выше энергии самой высокой из валентных орбиталей фтора – 2p — орбитали. Взаимодействие 1s-орбитали атома водорода и 2p — орбитали фтора приводит к образованию связывающей и разрыхляющей орбиталей, как показано на рисунке. Пара электронов, находящиеся на связывающей орбитали молекулы HF, образуют полярную ковалентную связь.
Для связывающей орбитали молекулы HF 2p — орбиталь атома фтора играет более важную роль, чем 1s — орбиталь атома водорода.
Для разрыхляющей орбитали молекулы HF наоборот: 1s — орбиталь атома водорода играет более важную роль, чем 2p — орбиталь атома фтора
Т.к. электроотрицательность фтора больше, чем электроотрицательность водорода, то на диаграмме, атомные орбитали фтора расположени ниже, чем атомная орбиталь водорода.
Определим порядок связи, т.е. кратность связи:
Т.о. в молекуле H-F связь одинарная.
Диаграмма МО молекулы СО
Электронная конфигурация внешнего слоя атомов углерода и кислорода:
С+6 1s2 2s2 2p2
O+8 1s2 2s2 2p4
Кислород более электроотрицательный элемент, поэтому его атомная орбиталь на диаграмме расположена ниже орбитали углерода.
Диаграмма МО молекулы СО имеет вид:
СO[KK(σs)2(σ*s)2(σx)2(πy)2(πz)2(π*y)]
Кратность связи равна:
n=(8-2)/2 = 3
Диаграмма молекулы NO приведена в разделе Задачи к разделу Химическая связь и строение молекул
2.3. Метод молекулярных орбиталей
Большей предсказательной силой обладает метод молекулярных орбиталей (МО). В нем молекула рассматривается как единая система ядер и электронов. Последние находятся в общем пользовании всех ядер атомов, образующих молекулу. Таким образом, метод МО химическую связь рассматривает как многоцентровую и многоэлектронную. В этом случае для приближенного решения уравнения Шредингера волновая функция, соответствующая молекулярной орбитали, задается как линейная комбинация атомных орбиталей, т. е. как сумма и разность атомных волновых функций с коэффициентами, указывающими на долю их вклада в перекрывание электронных облаков. При сложении атомных образование молекулярной орбитали:
ψ+ = с1 ψ1 + с2 ψ2,
ψ— = с3 ψ1 – с4 ψ2.
Полученный метод получил название линейной комбинации атомных орбиталей (ЛКАО МО).
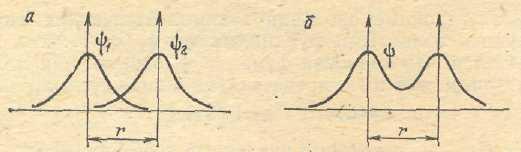
В методе ЛКАО МО для образования устойчивой молекулярной орбитали необходимо, чтобы энергии атомных орбиталей были близки друг к другу. Кроме того, нужно, чтобы их симметрия не сильно отличалась. При выполнении этих двух требований коэффициенты c1 и c2 должны быть близкими по своим значениям, а это, в свою очередь, обеспечивает максимальное перекрывание орбиталей. Образуется молекулярная орбиталь, энергия которой понижается относительно энергий атомных орбиталей. Такая молекулярная орбиталь называется связывающей. Волновая функция, соответствующая связывающей орбитали, получается в результате сложения волновых функций с одинаковым знаком. Электронная плотность при этом концентрируется между ядрами, и волновая функция принимает положительное значение. При вычитании атомных орбиталей энергия молекулярной орбитали повышается. Эта орбиталь называется разрыхляющей. Электронная плотность в этом случае располагается за ядрами, а между ними равна нулю. Волновая функция в двух образовавшихся электронных облаках имеет противоположные знаки, что хорошо видно из схемы образования связывающей и разрыхляющей орбиталей, приведенной на рис. 2.8:
Рис. 2.8. Схема образования связывающей
и разрыхляющей молекулярных орбиталей.
Рекомендуемые материалы
Когда атомная орбиталь одного из атомов вследствие большой разницы
в энергии или симметрии не может взаимодействовать с атомной орбиталью другого атома, она переходит в энергетическую схему молекулярных орбиталей молекулы с энергией, соответствующей ей в атоме. Орбиталь этого типа называется несвязывающей.
Классификация орбиталей на σ или π производится в соответствии с симметрией их электронных облаков аналогично σ — и π -связям в методе валентных связей: σ-орбиталь имеет такую симметрию электронного облака, при которой поворот ее вокруг оси, соединяющей ядра, на 1800 приводит к орбитали, по форме не отличимой от первоначальной. Знак волновой функции при этом не меняется. В случае же π -орбитали при повороте ее на 1800 знак волновой функции меняется на противоположный. Отсюда следует, что s-электроны атомов при взаимодействии между собой могут образовывать только σ -орбитали, а три p-орбитали атома – одну σ- и две π -орбитали, причем σ –орбиталь возникает при взаимодействии pХ атомных орбиталей, а π -орбиталь – при взаимодействии pY и pZ. Молекулярные π -орбитали повернуты относительно межъядерной оси на 900. Здесь наблюдается полная аналогия с методом валентных связей.
Рис. 2.9. Схема образования связывающих и разрыхляющих орбиталей
для 2р-атомных орбиталей.
Для того чтобы отличать связывающие и разрыхляющие орбитали друг
от друга, а также их происхождение, принята следующая система обозначений. Связывающая орбиталь обозначается сокращением «св», располагающимся справа вверху после греческой буквы, обозначающей орбиталь, а разрыхляющая – соответственно «разр». Принято еще одно обозначение: звездочкой помечаются разрыхляющие орбитали, а без звездочки – связывающие. После обозначения молекулярной орбитали пишется обозначение атомной орбитали, которой молекулярная обязана своим происхождением, например, πразр2pу. Это означает, что молекулярная орбиталь π-типа, разрыхляющая, образовалась при взаимодействии 2 pу -атомных орбиталей (рис. 2.9):
При рассмотрении электронного строения молекулы с точки зрения метода молекулярных орбиталей (МО) нужно руководствоваться следующими правилами:
1. Электроны в молекуле, как и в атоме, занимают соответствующие
орбитали, которые характеризуются своим набором квантовых чисел;
2. Число образующихся молекулярных орбиталей равно числу атомных
орбиталей участвующих в их образовании;
3. Распределение электронов по молекулярным орбиталям, так же как
и в атоме, подчиняется принципу наименьшей энергии, принципу Паули и
правилу Хунда;
4. Для молекул, образованных атомами одного химического элемента
(гомоядерных), выигрыш в энергии за счет образования связывающей орбитали компенсируется повышением энергии разрыхляющей орбитали.
На энергетической диаграмме обе орбитали располагаются симметрично
относительно атомных орбиталей (рис. 2.10):
Рис. 2.10. Энергетическая диаграмма молекулярных орбиталей
для гомоядерных молекул (на примере молекулы водорода)
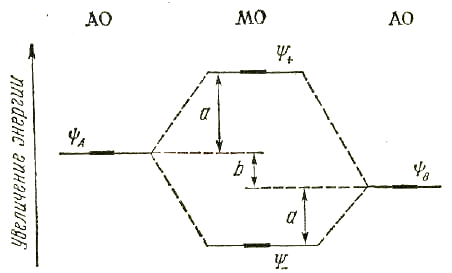
5. В гетероядерных (разноэлементных) молекулах связывающие орбитали по энергии ближе к орбиталям более электроотрицательного атома (B), а разрыхляющие – ближе к орбитали менее электроотрицательного атома (A). Разность в энергиях исходных атомных орбиталей (b) равна полярности связи. Эта разность является мерой ионности связи, а разность в энергиях между связывающей орбиталью и атомной орбиталью более электроотрицательного атома определяет ковалентность связи. (см. рис. 2.11):
Рис. 2.11. Энергетическая диаграмма молекулярных орбиталей
для гетероядерной молекулы.
6. Кратность химической связи равна половине разности числа электронов, расположенных на связывающих орбиталях, и числа электронов на разрыхляющих.
Для примера разберем энергетические диаграммы и электронное строение гетероядерных и гомоядерных молекул и ионов, образованных двумя атомами элементов первого и второго периодов Периодической системы.
У элементов первого периода валентной орбиталью является 1s- орбиталь. Эти две атомных орбитали образуют две σ-молекулярные орбитали – связывающую и разрыхляющую.
Рассмотрим электронное строение молекулярного иона Н2+. Он имеет один электрон, который будет занимать более энергетически выгодную s-связывающую орбиталь. В соответствии с правилом подсчета кратности связи она будет равна 0,5, а так как в ионе имеется один неспаренный электрон, Н2+ будет обладать парамагнитными свойствами. Электронное строение этого иона запишется по аналогии с электронным строением атома так: σсвяз1s1.
Появление второго электрона на s-связывающей орбитали приведет к энергетической диаграмме, описывающей молекулу водорода, возрастанию кратности связи до единицы и диамагнитным свойствам. Возрастание кратности связи повлечет за собой и увеличение энергии диссоциации молекулы H2 и более короткому межъядерному расстоянию по сравнению с аналогичной величиной у иона водорода. Электронное строение H2 можно записать так: σсвяз1s2.
Двухатомная молекула He2 существовать не будет, так как имеющиеся у двух атомов гелия четыре электрона расположатся на связывающей и разрыхляющей орбиталях, что приводит к нулевой кратности связи. Но в то же время ион He2+ будет устойчив и кратность связи в нем равна 0,5. Так же, как и ион водорода, этот ион будет обладать парамагнитными свойствами.
У элементов второго периода появляются еще четыре атомных орбитали: 2s, 2pХ, 2pY, 2pZ, которые будут принимать участие в образовании молекулярных орбиталей. Различие в энергиях 2s- и 2p-орбиталей велико, и они не будут взаимодействовать между собой с образованием молекулярных орбиталей. Эта разница в энергиях при переходе от первого элемента к последнему будет увеличиваться. В связи с этим обстоятельством электронное строение двухатомных гомоядерных молекул элементов второго периода будет описываться двумя энергетическими диаграммами, отличающимися порядком расположения на них σсвяз2pX и πСВ2py,z. При относительной энергетической близости 2s- и 2p-орбиталей, наблюдаемой в начале периода, включая атом азота, электроны, находящиеся на σразр2s- и σсвяз2pх-орбиталях, взаимно отталкиваются. Поэтому πСВ2py и πСВ2pz -орбитали оказываются энергетически более выгодными, чем σсвяз2pX -орбиталь. На рис.2.12 представлены обе диаграммы.
Так как участие 1s-электронов в образовании химической связи незначительно, их можно не учитывать при электронном описании строения молекул, образованных элементами второго периода.
Представленные на рис. 2.12 энергетические диаграммы, подтвержденные спектроскопическими данными, показывают следующий порядок размещения молекулярных орбиталей с увеличением энергии от Li2 до N2 включительно:
σсвяз1s< σразр1s<< σсвяз2s< σразр2s< πСВ2pУ = πСВ2pz < σсвяз2pX< πразр2pУ < πразр2pz << σразр2pX;
а от O2 и далее:
σсвяз1s< σразр1s<< σсвяз2s< σразр2s<< σсвяз2pX< πСВ2pУ = πСВ2pz < πразр2pУ < πразр2pz << σразр2pX.
Рис. 2.12. Энергетические диаграммы уровней двухатомных молекул
при значительном и незначительном энергетическом различии атомных 2s- и 2p-орбиталей.
Второй период системы открывают литий и бериллий, у которых внешний энергетический уровень содержит лишь s-электроны. Для этих элементов схема молекулярных орбиталей ничем не будет отличаться от энергетических диаграмм молекул и ионов водорода и гелия, с той лишь разницей, что у последних она построена из 1s-электронов, а у Li2 и Be2 –из 2s-электронов. 1s-электроны лития и бериллия можно рассматривать как несвязывающие, т. е. принадлежащие отдельным атомам. Здесь будут наблюдаться те же закономерности в изменении порядка связи, энергии диссоциации и магнитных свойств. Ион Li2+ имеет один неспаренный электрон, расположенный на σсвяз2s -орбитали – ион парамагнитен. Появление второго электрона на этой орбитали приведет к увеличению энергии диссоциации молекулы Li2 и возрастанию кратности связи с 0,5 до 1. Магнитные свойства приобретут диамагнитный характер. Третий s-электрон расположится на σразр2s -орбитали, что будет способствовать уменьшению кратности связи до 0,5 и, как следствие этого, понижению энергии диссоциации. Такое электронное строение имеет парамагнитный ион Be2+. Молекула Be2, так же как и He2, существовать не может из-за нулевого порядка связи. У этих молекул число связывающих электронов равно числу разрыхляющих.
Дальнейшее заполнение молекулярных энергетических уровней для
двухатомных гомоядерных молекул и некоторых ионов элементов второго
периода показано на рис. 2.13.Как видно из рисунка, по мере заполнения связывающих орбиталей энергия диссоциации молекул увеличивается, а с появлением электронов на разрыхляющих орбиталях уменьшается. Ряд заканчивается нестабильной молекулой Ne2. Из рисунка также видно, что удаление электрона с разрыхляющей орбитали приводит к повышению кратности связи и, как следствие этого, увеличению энергии диссоциации и уменьшению межъядерного расстояния. Ионизация молекулы, сопровождаемая удалением связывающего электрона дает прямо противоположный эффект.
Сравните энергетические диаграммы следующих двух пар молекул и
ионов: О2+, О2, N2+, N2, приведенные на рис. 2.13:
Рис. 2.13. Энергетические диаграммы двухатомных молекул и ионов
элементов второго периода Периодической системы.
Гетероядерные молекулы. Из двухатомных молекул самой прочной является молекула азота, кратность связи в которой равна трем. Логично предположить, что у гетероядерных молекул и однозарядных ионов, имеющих одинаковое число электронов с N2 – четырнадцать, – кратность связи будет такой же. Такими молекулами являются CO, BF, BeNe и ионы CN—, NO+, CF+, BO—. По аналогии с молекулой азота они должны обладать высокими значениями энергий диссоциации. Такой вывод нетрудно сделать, распространяя схему молекулярных орбиталей гомоядерных молекул на гетероядерные. При этом надо учитывать, что s- и p-орбитали с увеличением заряда ядра понижают свою энергию, а расщепление между ними по энергии растет. Вследствие этого появляются существенные отличия в образовании молекулярных орбиталей у некоторых гетероядерных молекул от гомоядерных. Проиллюстрируем это утверждение на примере иона NO+ и
молекулы CO.
Рис. 2.14. Энергетические диаграммы для иона NO+ (a) и молекулы СО (б).
Поскольку заряды ядер атомов азота и кислорода отличаются на единицу, существенного отличия в энергиях их атомных орбиталей не наблюдаетсяи схема молекулярных орбиталей иона NO+ будет аналогична схеме молекулярных орбиталей молекулы азота (рис. 2.14а). Все орбитали атома кислорода по энергии расположены ниже, чем соответствующие атомные орбитали атома углерода, т. к. заряд ядра кислорода на две единицы больше. Результатом этих энергетических различий будет существенное отличие молекулярных орбиталей оксида углерода от молекулярных орбиталей иона NO+ (рис. 2.14б). 2s-орбиталь кислорода располагается значительно ниже 2s-орбитали углерода, следствием чего является их слабое взаимодействие, приводящее к образованию слабосвязывающей σсв-орбитали, энергия которой практически не отличается от атомной 2s-орбитали кислорода. В то же время энергии 2p-орбиталей кислорода и 2s-орбитали углерода близки. Эта близость приводит к образованию двух σсв-связывающий и σразр-разрыхляющей орбиталей. Если верхняя занятая σ-орбиталь в ионе NO+ обладает ярко выраженным связывающим характером, то в молекуле CO эта орбиталь является слаборазрыхляющей. Поэтому ион СО+ имеет энергию диссоциации несколько большую, чем молекула СО. Образование других перечисленных выше молекул и ионов сомнительно, т. к. в них энергетические различия еще больше, чем у СО.
Металлическая связь. В отличие от ионных и ковалентных соединений металлы отличаются высокой электропроводностью и теплопроводностью. Высокая электропроводность металлов указывает на то, что электроны свободно могут передвигаться во всем его объеме. Иными словами металл можно рассматривать как кристалл, в узлах решетки которого расположены ионы, связанные электронами, находящимися в общем пользовании, т. е. в металлах имеет место сильно нелокализованная химическая связь. Совокупность электронов, обеспечивающих эту связь, называют электронным газом.
Более общий подход к представлению об ионных, ковалентных и металлических кристаллах можно получить, применяя представления метода молекулярных орбиталей к ним. Предположим, что твердое тело представляет из себя единую молекулу, образованную большим числом атомов. Внешние орбитали этих атомов при взаимодействии образуют связывающие и несвязывающие молекулярные орбитали. Энергетическая зона, образованная связывающими молекулярными орбиталями, называется валентной зоной. Зона, объединяющая несвязывающие орбитали, называется зоной проводимости. Энергетические различия электронов в пределах зоны малы, и изменение их энергии в зоне можно представить как непрерывную полосу энергии. Между зоной проводимости и валентной зоной отсутствуют какие-либо уровни энергий. Поэтому там электроны находиться не могут. Энергетическая зона, разделяющая валентную зону и зону проводимости, носит название запрещенной.
Рис. 23. Энергетические зоны в кристалле, образованные атомными орбиталями.
Электропроводность в твердом теле обеспечивается преодолением электронами запрещенной зоны, т. е. протекание электрического тока обеспечивается переходом электронов из валентной зоны в зону проводимости. В зависимости от ширины запрещенной зоны все твердые тела можно разделить на три класса: диэлектрики, полупроводники и проводники-металлы. Для изоляторов ширина запрещенной зоны составляет более 3 электронвольт, для полупроводников она лежит в пределах от 0,1 до 3 эВ. В металлах вследствие перекрывания валентной зоны и зоны проводимости запрещенная зона практически отсутствует.
Таблица 2.1
|
Число электронных пар |
Координация |
|
2 3 4 5 6 |
Линейная Правильный треугольник Тетраэдр Тригональная бипирамида Октаэдр |
Таблица 2.2
|
Число электронных пар |
Координация |
n |
m |
Тип молекулы |
Форма молекулы |
Примеры |
|
2 |
Линейная |
2 |
0 |
АХ2 |
Линейная |
BeH2, BeCl2 |
|
4 |
Тетраэдр |
4 3 2 |
0 1 2 |
АХ4 АХ3Е АХ2Е2 |
Тетраэдр Тригональ-ная бипи- рамида Угловая |
СН4, SiCl4 NH3, PH3 Н2О, SCl2 |
|
5 |
Тригональная бипирамида |
5 4 3 2 |
0 1 2 3 |
АХ5 АХ4Е АХ3Е2 АХ2Е2 |
Тригональная бипи- рамида Дисфеноид Т-образная Линейная |
PCl5,AsF5 SF4 ClF3 XeF2 |
|
6 |
Октаэдр |
6 5 4 |
0 1 2 |
АХ6 АХ5Е АХ4Е2 |
Лекция «Мухи» также может быть Вам полезна. Октаэдр Квадрат- ная бипи- рамида Плоский квадрат |
SF6 BrF5 XrF4 |
Метод валентных
связей дает теоретическое обоснование
широко применяемым химиками структурным
формулам и позволяет правильно определить
структуру практически всех соединений
s –иp
–элементов. Большое достоинство
метода в его наглядности. Однако
представление о локализованных
(двухцентровых, двухэлектронных)
химических связях оказывается слишком
узким для объяснения многих экспериментальных
фактов. В частности, метод валентных
связей несостоятелен для описания
молекул с нечетным числом электронов,
например,H,H
,
бораны, некоторые соединения с сопряженными
связями, ряд ароматических соединений,
карбонилы металлов, т.е. молекулы с
дефицитом электронов или их избытком
(H).
Обнаружились непреодолимые трудности
использования метода валентных связей
для объяснения валентности элементов
восьмой группы с фтором и кислородом
(XeF6, XeOF4,
XeO3и др.),
металлов в ”сэндвичевых” металлоорганических
соединениях, например, железа в ферроцене
Fe(C5H5)2,
где он должен был бы образовать связи
с десятью атомами углерода, не имея
такого количества электронов на внешней
оболочке.
На основе метода
ВСтрудно объяснить и то, что отрыв
электронов от некоторых молекул приводит
к упрочнению химической связи. Так,
энергия разрыва связи в молекулеF2составляет 38 ккал/моль, а в молекулярном
ионеF— 76 ккал/моль. Этот метод не
объясняет и парамагнетизм молекулярного
кислородаO2иB2.
Более общим и
универсальным оказался метод молекулярных
орбиталей (МО), при помощи которого
удается объяснить факты, непонятные с
позиции методаВС. Значительный
вклад в разработку методаМОвнес
американский ученый Р. Малликен (1927
– 1929 гг).
Основные понятия.В своей основе методМОраспространяет
квантово — механические закономерности,
установленные для атома, на более сложную
систему — молекулу. В основе метода
молекулярных орбиталей лежит представление
об »орбитальном» строении молекулы,
т.е. предположение о том, что все электроны
данной молекулы (как и в атоме)
распределяются по соответствующим
орбиталям. Каждая орбиталь характеризуется
набором квантовых чисел, отражающих
свойства электрона в данном энергетическом
состоянии. Особенность методаМОзаключается в том, что в молекуле имеется
нескольких атомных ядер, т.е. в отличие
от одноцентровых атомных орбиталей
молекулярные орбитали несколькоцентровые
(общие для двух и большего числа атомных
ядер). По аналогии с атомнымиs -, p -, d
-, f —орбиталями молекулярные орбитали
обозначаются греческими буквамиσ -,
π, δ -, φ.
Основная проблема
метода МО— нахождение волновых
функций, описывающих состояние электронов
на молекулярных орбиталях. Согласно
одному из вариантов метода молекулярных
орбиталей, названным линейной комбинацией
атомных орбиталей(МОЛКАО), молекулярные
орбитали образуются из атомных путем
их линейной комбинации. Пусть электронные
орбитали взаимодействующих атомов
характеризуются волновыми функциямиΨ1, Ψ2, Ψ3и т.д. Тогда предполагается, что волновая
функцияΨмол, отвечающая
молекулярной орбитали, может быть
представлена в виде суммы:
Ψмол.=
С1Ψ1 + С2Ψ2
+ С3Ψ3
+ …. .,
где С1,
С2, С3 …некоторые численные коэффициенты. Это
уравнение равносильно предположению,
что амплитуда молекулярной электронной
волны (т.е. молекулярная волновая функция)
образуется сложением амплитуд
взаимодействующих атомных электронных
волн (т. е. сложением атомных волновых
функций). При этом, однако, под влиянием
силовых полей ядер и электронов соседних
атомов волновая функция каждого электрона
изменяется по сравнению с исходной
волновой функцией этого электрона в
изолированном атоме. В методеМОЛКАОэти изменения учитываются введением
коэффициентовС1, С2,
С3 и т.д.
При построении
молекулярных орбиталей по методу МОЛКАОдолжны соблюдаться определенные условия:
1. Комбинируемые
атомные орбитали должны быть близкими
по энергии, иначе электрону будет
энергетически невыгодно находиться на
подуровне с более высокой энергией. (1
sи5 pне взаимодействуют).
2. Необходимо
максимальное перекрывание атомных
орбиталей, образующих молекулярную
орбиталь.
3. Атомные орбитали,
образующие молекулярные орбитали,
должны обладать одинаковыми свойствами
симметрии относительно межъядерной
оси молекулы. (px— электронное облако может комбинироваться
только сpxоблаком, но неpyиpz).
Следует также
учитывать, что совокупность молекулярных
орбиталей молекулы, занятых электронами,
представляет ее электронную конфигурацию.
Она строится так же как и для атома, на
основе принципа наименьшей энергии и
принципа Паули.
Для описания
электронной конфигурации основного
состояния молекулы с 2nили(2n — 1)электронами требуетсяn
молекулярных орбиталей.
Связывающие и
разрыхляющие орбитали. Рассмотрим,
какой вид будет иметь молекулярная
волновая функцияΨм,
образованная в результате взаимодействия
волновых функций (Ψ1иΨ2)1 sорбиталей двух
одинаковых атомов. Для этого найдем
суммуС1Ψ1
+ С2Ψ2. Поскольку
в данном случае атомы одинаковыеС1
= С2; они не будут влиять и
на характер волновых функций, поэтому
ограничимся нахождением суммыΨ1
+ Ψ2.
Для этого расположим
ядра взаимодействующих атомов на том
расстоянии друг от друга (r),
на котором они находятся в молекуле.
ВидΨ функций1 sорбиталей будет следующим:
Ψмол
Рис. 22. Схема
образования связывающей МО
из атомных 1 s
—орбиталей
Чтобы найти
молекулярную волновую функцию Ψ,
сложим величиныΨ1иΨ2.
В результате получим следующий вид
кривой (рис. 22)
Как видно, в
пространстве между ядрами значения
молекулярной волновой функции Ψмол.больше, чем значения исходных атомных
волновых функций. НоΨмол.характеризует вероятность нахождения
электрона в соответствующей области
пространства, т.е. плотность электронного
облака.
Возрастание Ψмол.– функции в сравнении сΨ1
иΨ2означает, что при
образовании молекулярной орбитали
плотность электронного облака в
межъядерном пространстве увеличивается,
в результате возникают силы притяжения
положительно заряженных ядер к этой
области – образуется химическая связь.
Поэтому молекулярная орбиталь
рассматриваемого типа называетсясвязывающей.
В данном случае
область повышенной электронной плотности
находится вблизи оси связи, так что
образовавшаяся МОотносится кσ
– типу. В соответствии с этим,
связывающаяМО, полученная в
результате взаимодействия двух атомных1s –орбиталей обозначаетсяσсв.1s.
Электроны, находящиеся на связывающейМО, называютсясвязывающими
электронами.
При взаимодействии
двух атомов знаки волновых функций их
1s –орбиталей
могут оказаться различными. Такой случай
графически можно представить следующим
образом:
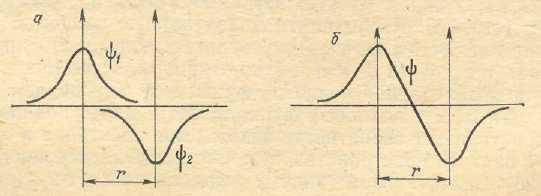
Рис. 23. Схема
образования разрыхляющей МО
из атомных 1 S
–орбиталей
Молекулярная
орбиталь (рис. 23), образующаяся при таком
взаимодействии, характеризуется
уменьшением абсолютной величины волновой
функции в межъядерном пространстве по
сравнению с ее значением в исходных
атомах: на оси связи
появляется даже
точка, в которой значение волновой
функции, а, следовательно, и ее квадрата,
обращается в нуль. Это означает, что в
рассматриваемом случае уменьшится и
плотность электронного облака в
пространстве между атомами. В результате
притяжения каждого атомного ядра в
направлении к межъядерной области
пространства окажется более слабым,
чем в противоположном направлении, т.е.
возникнут силы, приводящие к взаимному
отталкиванию ядер. Здесь, следовательно,
химическая связь не возникает;
образовавшаяся в этом случае МОназываетсяразрыхляющей(σразр.1s),
а находящиеся на ней электроны –разрыхляющимиэлектронами.

орбитали, полученные при сложении и
вычитании 1s –атомных орбиталей имеют следующие формы
(рис. 24). Взаимодействие, приводящее к
образованию связывающей орбитали,
сопровождается выделением энергии,
поэтому электрон, находящийся на
связывающей орбитали, обладает меньшей
энергией, чем в исходном атоме.
Рис. 24. Схема
образования связывающей и разрыхляющей
молекулярных σ
—орбиталей
Образование
разрыхляющей орбитали требует затраты
энергии. Следовательно, на разрыхляющей
орбитали электрон обладает более высокой
энергией, чем в исходном атоме.
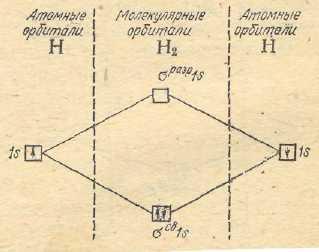
гомоядерные молекулы элементов первого
периода.Образование молекулы
водородаH2по методуМОпредставляется следующим
образом (рис. 25):
Рис. 25. Энергетическая
диаграмма образования
молекулярных
орбиталей H2
Следовательно,
вместо двух энергетически равноценных
1 s –орбиталей
(исходные атомы водорода) при образовании
молекулыH2возникают две энергетически неравноценные
молекулярные орбитали – связывающая
и разрыхляющая.
В этом случае 2
элемента занимают молекулярную орбиталь
с более низкой энергией, т.е. σсв
1 sорбиталь.
Реакция образования
молекулы H2в терминахМОможет быть записана:
2 H [1
s1]
= H2 [
(σ св1
s)2]
или
H [1 s1]
+ H [1 s1]
= H2 [(σ
св1 s)2]
В молекуле H2
два электрона. Согласно принципу
наименьшей энергии и принципу Паули
эти два электрона с противоположными
спинами также заселяютσ сворбиталь.
Приведенная
энергетическая диаграмма молекулярных
орбиталей справедлива для двухъядерных
образований (элементами первого периода):
H2+,
He2+иHe2
В молекулярном
дигелии – ионе He2+три электрона, два из которых заселяют
связывающую, третий – разрыхляющую
орбитальHe2+
[(σсв 1 s)2
(σразр 1 s)](рис. 26):
Рис. 26. Энергетическая
диаграмма образования
молекулярных
орбиталей He

H2+состоит из двух протонов и одного
электрона. Естественно, что единственный
электрон этого иона должен занимать
энергетически наиболее выгодную
орбиталь, т.е.σ св1s.
Таким образом, электронная формула ионаH2+
H2
+[( σсв
1s)‘](рис. 27):
Рис. 27. Энергетическая
диаграмма образования
молекулярных
орбиталей H
В системе из двух
атомов гелия He2четыре электрона; два на связывающей и
два на разрыхляющей орбитали.
Энергия, длина
и порядок связи. По характеру
распределения электронов по молекулярным
орбиталям можно оценить энергию и
порядок связи. Как уже было показано,
нахождение электрона на связывающей
орбитали означает, что электронная
плотность концентрируется между ядрами,
что обуславливает сокращение межъядерного
расстояния и упрочения молекулы. Наоборот
электрон на разрыхляющей орбитали
означает, что электронная плотность
концентрируется за ядрами. В этом случае,
следовательно, энергия связывания
снижается, а межъядерное расстояние
увеличивается, как это показано ниже.
ряду H2+
— H2 — He2+по мере заполнения связывающей орбитали,
энергия диссоциации молекул возрастает,
с появлением же электрона на разрыхляющейМО, наоборот, уменьшается, а затем
увеличивается.
Молекула гелия
существовать не может в невозбужденном
состоянии, так как число связывающих и
разрыхляющих электронов у нее одинаково.
Согласно методу
МОпорядок связи (кратность)(n)оценивается полуразностью числа
связывающих и разрыхляющих электронов:
,
где
a
–число электронов на связывающих
орбиталях;
b— число электронов на разрыхляющих
орбиталях.
или
,
гдеА –число атомов в молекуле.
Нетрудно подсчитать,
что в молекулярном ионе водорода и
дигелии – ионе порядок связи равен 0,5,
в молекуле водорода 1, а в системе из
двух атомов гелия – нулю.
Двухатомные
гомоядерные молекулы элементов второго
периода.У элементов 2 – го периода
кроме1 s –орбиталей в образованииМОпринимают
участие2s -; 2px
— , 2pyи2pz– орбитали.
Комбинация из 2s
–орбиталей, как и в случае атомных1s – орбиталей,
соответствует образованию двух
молекулярныхσ – орбиталей:σсв2s
иσразр2s.
Иная картина
наблюдается при комбинации орбиталей
p – типа. При комбинации атомных2px– орбиталей, которые вытянуты вдоль
осих, возникают молекулярныеσ –орбитали:σсв2px
иσразр2px.
При комбинации
2pyи2pz
атомных орбиталей образуютсяπсв2pyиπсв2pz,πразр2pyиπразр2pz.
Поскольку энергия
2pyи2pz
— орбиталей одинакова и перекрываются
они одинаковым способом, возникающиеπсв2pyиπсв2pz– орбитали имеют одинаковую энергию и
форму; то же самое относится кπразр2pyиπразр2pz
– орбиталям. Таким образом,
молекулярныеπ –орбитали составляютπсвиπразрдважды вырожденные энергетические
уровни.
Согласно
спектроскопическим данным МОдвухатомных молекул элементов конца
периода по уровню энергии располагаются
в следующем порядке:
σсв1s
< σразр1s
< σсв2s
< σразр2s
< σсв2px
< πсв2py
= πсв2pz
< πразр2py
= πразр2pz
< σразр2px
При энергетической
близости 2sи2p– орбиталей электроны наσ 2sиσ 2p– орбиталях
взаимно отталкиваются и потомуπсв2pyиπсв2pz
— орбитали оказываются энергетически
более выгодными, чемσсв2pxорбиталь. В этом случае порядок заполнения
молекулярных орбиталей несколько
изменяется и соответствует следующей
последовательности:
σсв1s
< σразр1s
< σсв2s
< σразр2s
< πсв2py
= πсв2pz
< σсв2px
< πразр2py
= πразр2pz
< σразр2px
Энергетическое
различие 2sи2p
–орбиталей в периоде увеличивается
отIгруппы кVIII.
Поэтому приведенная последовательность
молекулярных орбиталей характерна для
двухатомных молекул элементов началаII– го периода вплоть
доN2. Так,
электронная конфигурацияN2.
в основном (невозбужденном) состоянии
имеет вид:
2N [1s2
2s2
2p3]
= N 2 [(σсв1s)
2
(σразр1s)
2
(σсв2s)
2
(σразр2s)
2
* (πсв2py)
2
(πсв2pz)
2
(σсв.2px)
2]
или
графически (рис. 28):
АО
МО АО
N 1s2
2s2
2p3
N 2
1s2
2s2
2p3
Рис. 28.
Энергетическая диаграмма образования
молекулярных
орбиталей N2
Характер распределения
электронов по молекулярным орбиталям
позволяет объяснить также магнитные
свойства молекул. По магнитным свойствам
различают парамагнитные идиамагнитныевещества. Парамагнитными являются
вещества, у которых имеются непарные
электроны, у диамагнитных веществ –
все электроны парные.
В таблице приведены
сведения об энергии, длине и порядке
связи гомоядерных молекул элементов
начала и конца 2 – ого периода:
молекуле кислорода имеется два непарных
электрона, поэтому она парамагнитна;
молекула фтора непарных электронов не
имеет, следовательно, она диамагнитна.
Парамагнитны также молекула B2и молекулярные ионыH2+иHe2+,
а молекулыС2, N2
иH2–
диамагнитны.
Двухатомные
гетероядерные молекулы.Гетероядерные
(разноэлементные) двухатомные молекулы
описывают методомМОЛКАО, так же
как гомоядерные двухатомные молекулы.
Однако поскольку речь идет о разных
атомах, то энергия атомных орбиталей и
их относительный вклад в молекулярные
орбитали тоже различны:
Ψ+
= С1 ΨА + С2
ΨB
Ψ—
= С3 ΨА + С4
ΨB
Рис. 29. Энергетическая
диаграмма молекулярных орбиталей
гетероядерной молекулы АВ
В связывающую
орбиталь больший вклад вносит атомная
орбиталь более электроотрицательного
атома, а в разрыхляющую – орбиталь менее
электроотрицательного элемента (рис.
29). Допустим, атом Bэлектроотрицательнее атомаA.
ТогдаС2> С1,
аС3 > С4.
Различие в энергии
исходных атомных орбиталей определяет
полярность связи. Величина вявляется
мерой ионности,
а величина a
– ковалентности связи.
Диаграмма
энергетических уровней гетероядерных
двухатомных молекул 2 – го периода
аналогична диаграмме гомоядерных
молекул 2 – го периода. Например,
рассмотрим рас-пределение электронов
по орбиталям молекулы COи ионовCN—иNO+.
Молекула COи ионыCN—,
NO+изоэлектронны молекулеN2
(содержит по 10 валентных электронов),
что соответствует следующей электронной
конфигурации в невозбужденном состоянии:
(σsсв.)2
(σsразр.)2
(πусв.)2
(πzсв.)2
(σхсв.)2
Энергетическая
диаграмма уровней молекулы BeH2
имеет вид: Четыре валентных электрона
невозбужденной молекулыBeH2располагаются наσ
иσ
— орбиталях, что описывается формулой(σ
)
2 (σ
)2.
М.А.АХМЕТОВ
Конспект лекций
по общей химии
Продолжение. Начало см. в № 8, 12, 13, 20, 23/2004
Глава 3. Химическая связь
3.4. Метод молекулярных орбиталей
Метод молекулярных орбиталей (МО) наиболее
нагляден в его графической модели линейной
комбинации атомных орбиталей (ЛКАО). Метод МО
ЛКАО основан на следующих правилах.
1. При сближении атомов до расстояний
химических связей из атомных орбиталей (АО)
образуются молекулярные.
2. Число полученных молекулярных орбиталей
равно числу исходных атомных.
3. Перекрываются атомные орбитали, близкие по
энергии. В результате перекрывания двух атомных
орбиталей образуются две молекулярные. Одна из
них имеет меньшую энергию по сравнению с
исходными атомными и называется связывающей,
а вторая молекулярная орбиталь обладает большей
энергией, чем исходные атомные орбитали, и
называется разрыхляющей.
4. При перекрывании атомных орбиталей
возможно образование и -связи (перекрывание по оси химической
связи), и -связи
(перекрывание по обе стороны от оси химической
связи).
5. Молекулярная орбиталь, не участвующая в
образовании химической связи, носит название несвязывающей.
Ее энергия равна энергии исходной АО.
6. На одной молекулярной орбитали (как,
впрочем, и атомной) возможно нахождение не более
двух электронов.
7. Электроны занимают молекулярную орбиталь
с наименьшей энергией (принцип наименьшей
энергии).
8. Заполнение вырожденных (с одинаковой
энергией) орбиталей происходит последовательно
по одному электрону на каждую из них.
Применим метод МО ЛКАО и разберем строение
молекулы водорода. Изобразим на двух
параллельных диаграммах энергетические уровни
атомных орбиталей исходных атомов водорода
(рис. 3.5).
|
|
Рис. 3.5.
|
Далее мысленно перекроем две атомные
орбитали, образовав две молекулярные, одна из
которых (связывающая) обладает меньшей энергией
(расположена ниже), а вторая (разрыхляющая) –
большей энергией (расположена выше) (рис. 3.6.).
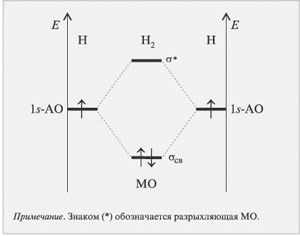 |
Рис. 3.6.
|
Видно, что имеется выигрыш в энергии по
сравнению с несвязанными атомами. Свою энергию
понизили оба электрона, что соответствует
единице валентности в методе валентных связей
(связь образуется парой электронов).
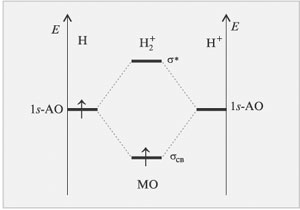
Метод МО ЛКАО позволяет наглядно объяснить
образование ионов и
, что
вызывает трудности в методе валентных связей. На -связывающую
молекулярную орбиталь катиона переходит один электрон атома H
с выигрышем энергии (рис. 3.7).
|
|
Рис. 3.7.
|
В анионе на двух молекулярных орбиталях
необходимо разместить уже три электрона
(рис. 3.8).
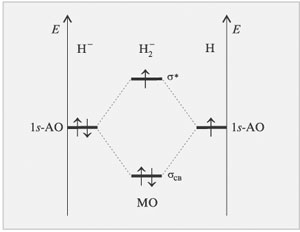 |
Рис. 3.8.
|
Если два электрона, опустившись на
связывающую орбиталь, дают выигрыш в энергии, то
третьему электрону приходится повысить свою
энергию. Однако энергия, выигранная двумя
электронами, больше, чем проигранная одним. Такая
частица может существовать.
Известно, что щелочные металлы в газообразном
состоянии существуют в виде двухатомных молекул.
Попробуем убедиться в возможности существования
двухатомной молекулы Li2, используя метод МО
ЛКАО. Исходный атом лития содержит электроны на
двух энергетических уровнях – первом и втором (1s
и 2s) (рис. 3.9).
|
|
Рис. 3.9.
|
Перекрывание одинаковых 1s-орбиталей
атомов лития даст две молекулярные орбитали
(связывающую и разрыхляющую), которые согласно
принципу минимума энергии будут полностью
заселены четырьмя электронами. Выигрыш в
энергии, получаемый в результате перехода двух
электронов на связывающую молекулярную
орбиталь, не способен компенсировать ее потери
при переходе двух других электронов на
разрыхляющую молекулярную орбиталь. Вот почему
вклад в образование химической связи между
атомами лития вносят лишь электроны внешнего
(валентного) электронного слоя.
Перекрывание валентных 2s-орбиталей атомов
лития приведет также к образованию одной
-связывающей и
одной разрыхляющей молекулярных орбиталей. Два
внешних электрона займут связывающую орбиталь,
обеспечивая общий выигрыш в энергии (кратность
связи равна 1).
Используя метод МО ЛКАО, рассмотрим возможность
образования молекулы He2 (рис. 3.10).
|
|
Рис. 3.10.
|
В этом случае два электрона займут
связывающую молекулярную орбиталь, а два других
– разрыхляющую. Выигрыша в энергии такое
заселение двух орбиталей электронами не
принесет. Следовательно, молекулы He2 не
существует.
Методом МО ЛКАО легко продемонстрировать
парамагнитные свойства молекулы кислорода. С тем
чтобы не загромождать рисунок, не будем
рассматривать перекрывание 1s-орбиталей
атомов кислорода первого (внутреннего)
электронного слоя. Учтем, что p-орбитали
второго (внешнего) электронного слоя могут
перекрываться двумя способами. Одна из них
перекроется с аналогичной с образованием -связи (рис. 3.11).
|
|
Рис. 3.11.
|
Две других p-АО перекроются по обе
стороны от оси x с образованием двух -связей (рис. 3.12).
|
|
Рис. 3.12.
|
Энергии сконструированных
молекулярных орбиталей могут быть определены по
данным спектров поглощения веществ в
ультрафиолетовой области. Так, среди
молекулярных орбиталей молекулы кислорода,
образовавшихся в результате перекрывания p-АО,
две -связывающие
вырожденные (с одинаковой энергией) орбитали
обладают меньшей энергией, чем -связывающая, впрочем, как и
*-разрыхляющие
орбитали обладают меньшей энергией в сравнении с
*-разрыхляющей
орбиталью (рис. 3.13).
|
|
Рис. 3.13.
|
В молекуле O2 два электрона с
параллельными спинами оказались на двух
вырожденных (с одинаковой энергией) *-разрыхляющих
молекулярных орбиталях. Именно наличием
неспаренных электронов и обусловлены
парамагнитные свойства молекулы кислорода,
которые станут заметными, если охладить кислород
до жидкого состояния.
Среди двухатомных молекул одной из наиболее
прочных является молекула CO. Метод МО ЛКАО легко
позволяет объяснить этот факт (рис. 3.14, см. с.
18).
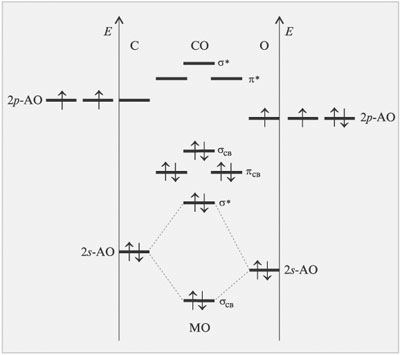 |
Рис. 3.14.
|
Результатом перекрывания p-орбиталей
атомов O и C является образование двух
вырожденных
-связывающих и
одной -связывающей
орбитали. Эти молекулярные орбитали займут шесть
электронов. Следовательно, кратность связи равна
трем.
Метод МО ЛКАО можно использовать не только для
двухатомных молекул, но и для многоатомных.
Разберем в качестве примера в рамках данного
метода строение молекулы аммиака (рис. 3.15).
|
|
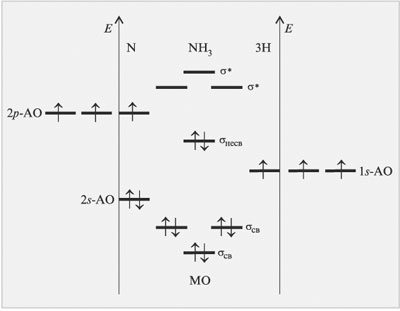
Рис. 3.15.
|
Поскольку три атома водорода имеют
только три 1s-орбитали, то суммарное число
образованных молекулярных орбиталей будет равно
шести (три связывающих и три разрыхляющих). Два
электрона атома азота окажутся на несвязывающей
молекулярной орбитали (неподеленная электронная
пара).
3.5. Геометрические формы молекул
Когда говорят о формах молекул, прежде всего
имеют в виду взаимное расположение в
пространстве ядер атомов. О форме молекулы имеет
смысл говорить, когда молекула состоит из трех и
более атомов (два ядра всегда находятся на одной
прямой). Форма молекул определяется на основе
теории отталкивания валентных (внешних)
электронных пар. Согласно этой теории молекула
всегда будет принимать форму, при которой
отталкивание внешних электронных пар минимально
(принцип минимума энергии). При этом необходимо
иметь в виду следующие утверждения теории
отталкивания.
1. Наибольшее отталкивание претерпевают
неподеленные электронные пары.
2. Несколько меньше отталкивание между
неподеленной парой и парой, участвующей в
образовании связи.
3. Наименьшее отталкивание между электронными
парами, участвующими в образовании связи. Но и
этого бывает недостаточно, чтобы развести ядра
атомов, участвующих в образовании химических
связей, на максимальный угол.
В качестве примера рассмотрим формы водородных
соединений элементов второго периода: BeH2, BH3,
CH4, C2H4, C2H2, NH3, H2O.
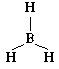
Начнем с определения формы молекулы BeH2.
Изобразим ее электронную формулу:
H:Be:H,
из которой ясно, что в молекуле отсутствуют
неподеленные электронные пары. Следовательно,
для электронных пар, связывающих атомы, есть
возможность оттолкнуться на максимальное
расстояние, при котором все три атома находятся
на одной прямой, т.е. угол HBeH составляет 180°.
Молекула BH3 состоит из четырех атомов.
Согласно ее электронной формуле в ней
отсутствуют неподеленные пары электронов:
Молекула приобретет такую форму, при которой
расстояние между всеми связями максимально, а
угол между ними равен 120°. Все четыре атома
окажутся в одной плоскости – молекула плоская:
Электронная формула молекулы метана выглядит
следующим образом:
Все атомы данной молекулы не могут оказаться в
одной плоскости. В таком случае угол между
связями равнялся бы 90°. Есть более оптимальное (с
энергетической точки зрения) размещение атомов
– тетраэдрическое. Угол между связями в этом
случае равен 109°28′.
Электронная формула этена имеет вид:
Естественно, все углы между химическими
связями принимают максимальное значение – 120°.
Очевидно, что в молекуле ацетилена все атомы
должны находиться на одной прямой:
H:C:::C:H.
Отличие молекулы аммиака NH3 от всех
предшествующих состоит в наличии в ней
неподеленной пары электронов у атома азота:
Как уже указывалось, от неподеленной
электронной пары более сильно отталкиваются
электронные пары, участвующие в образовании
связи. Неподеленная пара располагается
симметрично относительно атомов водорода в
молекуле аммиака:
Угол HNH меньше, чем угол HCH в молекуле метана
(вследствие более сильного электронного
отталкивания).
В молекуле воды неподеленных пар уже две:
Этим обусловлена уголковая форма молекулы:
Как следствие более сильного отталкивания
неподеленных электронных пар, угол HOH еще меньше,
чем угол HNH в молекуле аммиака.
Приведенные примеры достаточно наглядно
демонстрируют возможности теории отталкивания
валентных электронных пар. Она позволяет
сравнительно легко предсказывать формы многих
как неорганических, так и органических молекул.
3.6. Упражнения
1. Какие виды связей можно отнести к
химическим?
2. Какие два основных подхода к
рассмотрению химической связи вам известны? В
чем состоит их отличие?
3. Дайте определение валентности и
степени окисления.
4. В чем состоят отличия простой
ковалентной, донорно-акцепторной, дативной,
металлической, ионной связей?
5. Как классифицируют
межмолекулярные связи?
6. Что такое электроотрицательность?
Из каких данных электроотрицательность
рассчитывается? О чем электроотрицательности
атомов, образующих химическую связь, позволяют
судить? Как изменяется электроотрицательность
атомов элементов при продвижении в
периодической таблице Д.И.Менделеева сверху вниз
и слева направо?
7. Какими правилами необходимо
руководствоваться при рассмотрении строения
молекул методом МО ЛКАО?
8. Используя метод валентных связей,
объясните строение водородных соединений
элементов
2-го периода.
9. Энергия диссоциации в ряду молекул
Cl2, Br2, I2 уменьшается
(239 кДж/моль, 192 кДж/моль, 149 кДж/моль
соответственно), однако энергия диссоциации
молекулы F2 (151 кДж/моль) значительно
меньше, чем энергия диссоциации молекулы Cl2,
и выпадает из общей закономерности. Объясните
приведенные факты.
10. Почему при обычных условиях CO2
– газ, а SiO2 – твердое вещество, H2O –
жидкость,
а H2S – газ? Попробуйте объяснить агрегатное
состояние веществ.
11. Используя метод МО ЛКАО, объясните
возникновение и особенности химической связи в
молекулах B2, C2, N2, F2, LiH, CH4.
12. Используя теорию отталкивания
валентных электронных пар, определите формы
молекул кислородных соединений элементов 2-го
периода.