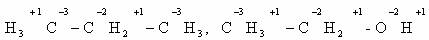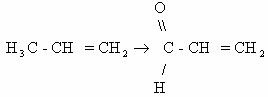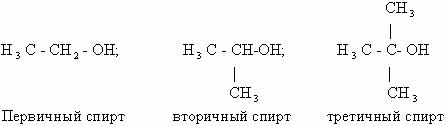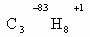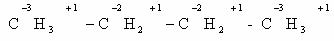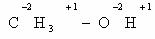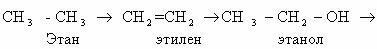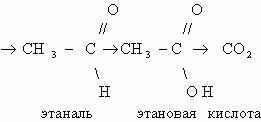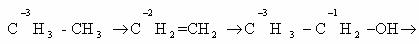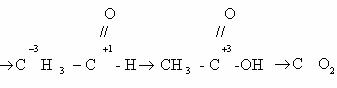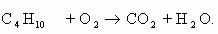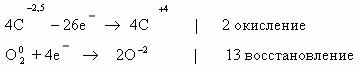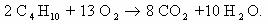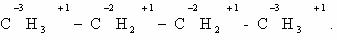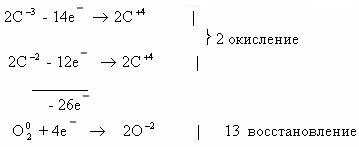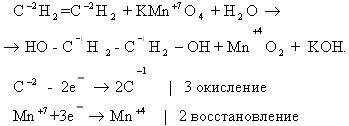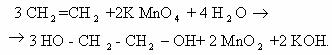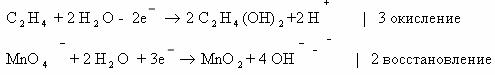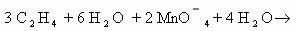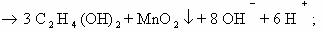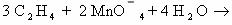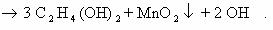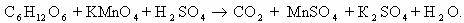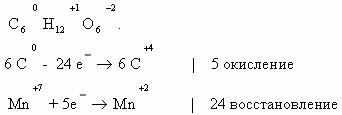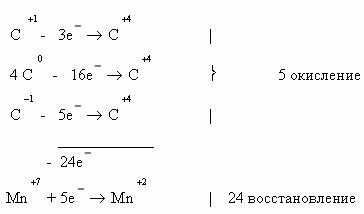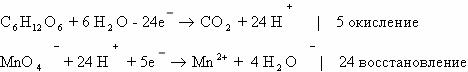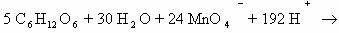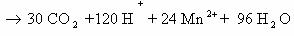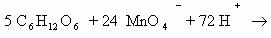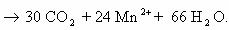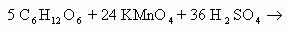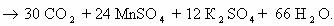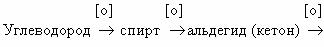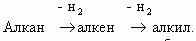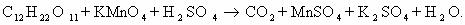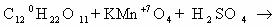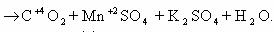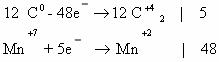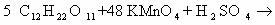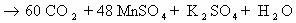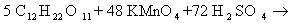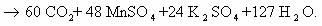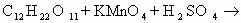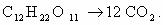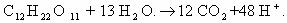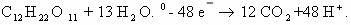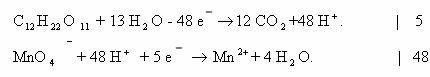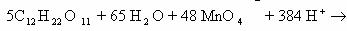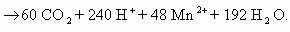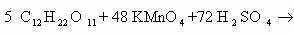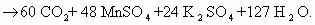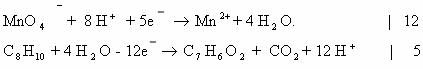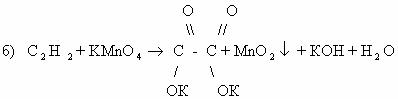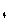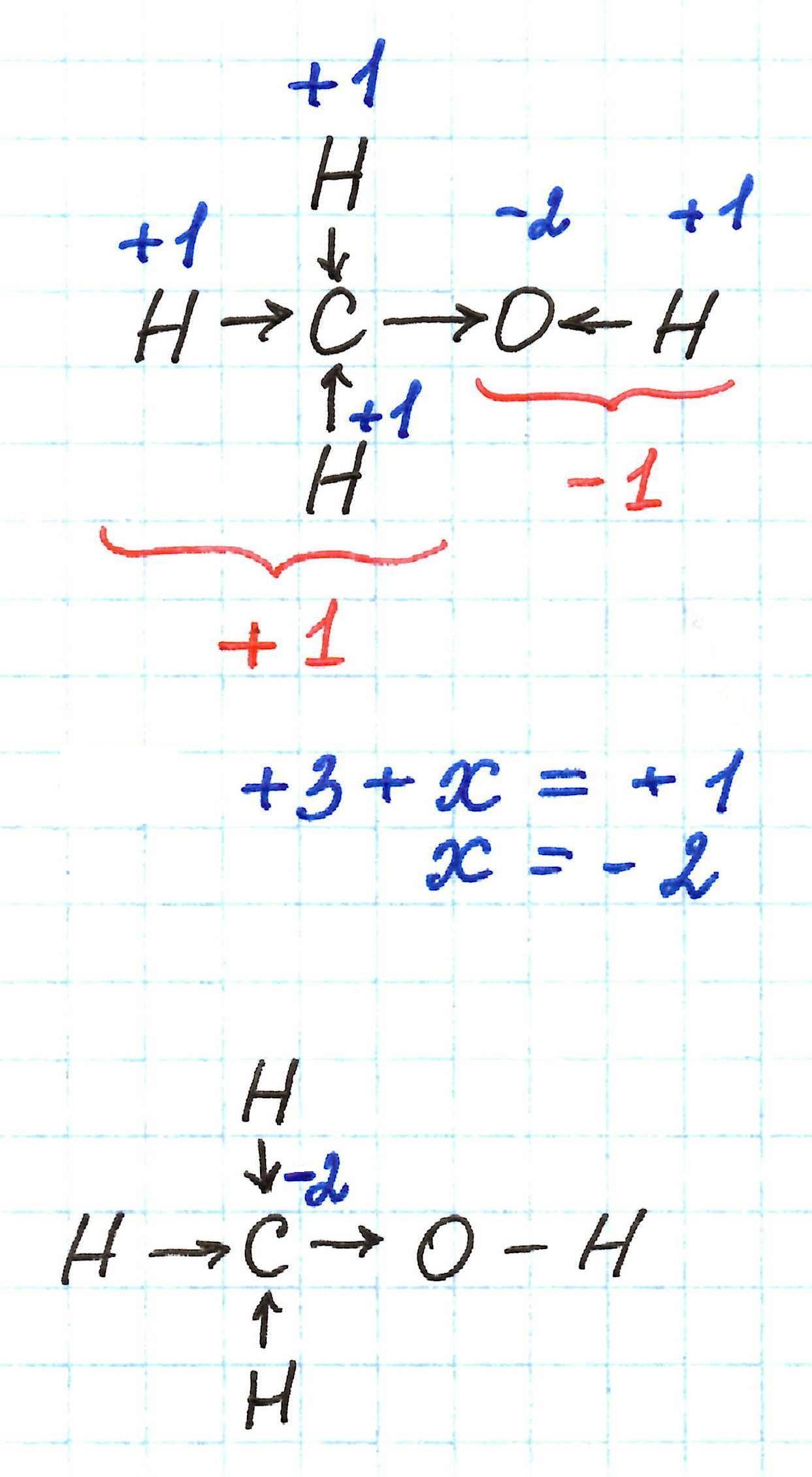to continue to Google Sites
Not your computer? Use Guest mode to sign in privately. Learn more
Окислительно-восстановительные процессы издавна интересовали
химиков и даже алхимиков. Среди химических реакций, происходящих в природе,
быту и технике, огромное множество составляют окислительно-восстановительные:
сгорание топлива, окисление питательных веществ, тканевое дыхание, фотосинтез,
порча пищевых продуктов и т.д. В таких реакциях могут участвовать как
неорганические вещества, так и органические. Однако если в школьном курсе
неорганической химии разделы, посвященные окислительно-восстановительным
реакциям, занимают значительное место, то в курсе органической химии на этот
вопрос обращено недостаточно внимания.
Что же представляют собой восстановительно-окислительные
процессы?
Все химические реакции можно разделить на два типа. К
первому относятся реакции, протекающие без изменения степени окисления атомов,
входящих в состав реагирующих веществ.
Ко второму типу относятся все реакции, идущие с изменением
степени окисления атомов, входящих в состав реагирующих веществ.
Реакции, протекающие с изменением степени окисления атомов,
входящих в состав реагирующих веществ, называются
окислительно-восстановительными.
С современной точки зрения изменение степени окисления
связано с оттягиванием или перемещением электронов. Поэтому наряду с
приведенным можно дать и такое определение восстановительно-окислительных
реакций: это такие реакции, при которых происходит переход электронов от одних
атомов, молекул или ионов к другим.
Рассмотрим основные положения, относящиеся к теории
окислительно-восстановительных реакций.
1. Окислением называется процесс отдачи электроном атомом,
молекулой или ионом электронов, степени окисления при этом повышаются.
2. Восстановлением называется процесс присоединения
электронов атомом, молекулой или ионом, степень окисления при этом понижается.
3. Атомы, молекулы или ионы, отдающие электроны, называются
восстановителями. Во время реакции они окисляются. Атомы, молекулы или ионы,
присоединяющие электроны, называются окислителями. Во время реакции они
восстанавливаются.
4. Окисление всегда сопровождается восстановлением;
восстановление всегда связано с окислением, что можно выразить уравнениями.
Поэтому окислительно-восстановительные реакции представляют
собой единство двух противоположных процессов – окисления и восстановления. В
этих реакциях число электронов, отдаваемых восстановителем, равно числу
электронов, присоединяемых окислителем. При этом независимо от того, переходят
ли электроны с одного атома на другой полностью или лишь частично оттягиваются
к одному из атомов, условно говорят только об отдаче и присоединения
электронов.
Окислительно-восстановительные реакции органических веществ
– важнейшее свойство, объединяющее эти вещества. Склонность органических
соединений к окислению связывают с наличием кратных связей, функциональных
групп, атомов водорода при атоме углерода, содержащем функциональную группу.
Применение понятия «степени окисления» (СО) в органической
химии очень ограничено и реализуется, прежде всего, при составлении уравнений окислительно-восстановительных
реакций. Однако, учитывая, что более или менее постоянной состав продуктов
реакции возможен только при полном окислении (горении) органических веществ,
целесообразность расстановки коэффициентов в реакциях неполного окисления
отпадает. По этой причине обычно ограничиваются составлением схемы превращений
органических соединений.
Нам представляется важным указывать значение СО атома
углерода при изучении всей совокупности свойств органических соединений.
Систематизация сведений об окислителях, установление связи между строением
органических веществ и их СО помогут научить учащихся [1, 2]:
— Выбирать лабораторные и промышленные окислители;
Находить зависимость окислительно-восстановительной
способности органического вещества от его строения;
— Устанавливать связь между классом органических веществ и
окислителем нужной силы, агрегатного состояния и механизма действия;
— Предсказывать условия проведения реакции и ожидаемые
продукты окисления.
Определение степени окисления атомов в органических веществах
Степень окисления любого атома углерода в органическом
веществе равна алгебраической сумме всех его связей с более
электроотрицательных элементов (Cl, O,
S,N, и др.), учитываемых со
знаком «+», и связей с атомами водорода (или другого более
электроположительного элемента), учитываемых со знаком «-». При этом связи с
соседними атомами углерода не учитываются [1].
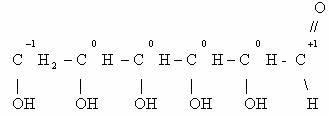
Определим степени окисления атомов углерода в молекулах
предельного углеводорода пропана и спирта этанола:
Последовательное окисление органических веществ можно
представить в виде следующей цепочки превращений:
Насыщенный углеводород 



CO
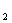
Генетическая связь между классами органических соединений представляется
здесь как ряд окислительно–восстановительных реакций, обеспечивающих переход от
одного класса органических соединений к другому. Завершают его продукты полного
окисления (горения) любого из представителей классов органических соединений.
Приложение. Таблица №1.
Изменение СО у атомов углерода в молекуле углерода в
молекулах органических соединений приведены в таблице. Из данных таблицы
видно, что при переходе от одного класса органических соединений к другому и
увеличения степени разветвленности углеродного скелета молекул соединений
внутри отдельного класса степень окисления атома углерода, ответственного за
восстанавливающую способность соединения, изменяется. Органические вещества, в
молекулах которых содержатся атомы углерода с максимальными (- и +) значениями
СО (-4, -3, +2, +3), вступают в реакцию полного окисления-горения, но устойчивых
к воздействию мягких окислителей и окислителей средней силы. Вещества, в
молекулах которых содержится атомы углерода в СО -1; 0; +1, окисляются легко,
восстановительные способности их близки, поэту их неполное окисление может быть
достигнуто за счет одного из известных окислителей малой и средней силы. Эти
вещества могут проявлять двойственную природу, выступая и в качестве
окислителя, подобно тому, как это присуще неорганическим веществам.
Окисление и восстановление органических веществ
Повышенная склонность органических соединений к окислению обусловлена
наличием в молекуле веществ [1, 2]:
- кратных связей (именно поэтому так легко окисляются алкены,
алканы, алкадиены); - определенных функциональных групп – сульфидной -SH, гидроксильной –OH (фенольной и
спиртовой), аминной — NH;
- активированных алкильных групп, расположенных по соседству
с кратными связям, например пропен может быть окислен до непредельного
альдегида акролеина (кислородом воздуха в присутствии водяных паров на
висмут- молибденовых катализаторах):
- атомов водорода при атоме углерода, содержащем функциональную
группу.
Сравним первичные, вторичные и третичные спирты по
реакционной способности к окислению:
Первичные и вторичные спирты, имеющие атомы водорода при
атоме углерода, несущем функциональную группу; окисляются легко: первые – до
альдегидов, вторые до кетонов. При этом структура углеродного скелета исходного
спирта сохраняется. Третичные спирты, в молекулах которых нет атома водорода
при атоме углерода, содержащем группу ОН, в обычных условиях не окисляются. В
жестких условиях (при действии сильных окислителей и при высоких температурах)
они могут быть окислены до смеси низкомолекулярных карбоновых кислот, т.е.
происходит деструкция углеродного скелета.
Существуют два подхода к определению степеней окисления
элементов в органических веществах.
1. Вычисляют среднюю степень окисления атома углерода в
молекуле органического соединения, например пропана.
Такой подход оправдан, если в ходе реакции в органическом
веществе разрушаются все химические связи (горение, полное разложение).
Отметим, что формально дробные степени окисления,
вычисленные таким образом, могут быть и в случае неорганических веществ.
Например, в соединении КО
кислорода равна – 1/2.
2. Определяют степень окисления каждого атома углерода,
например в бутане.
В этом случае степень окисления любого атома углерода в
органическом соединении равна алгебраической сумме чисел всех связей с атомами
более электроотрицательных элементов, учитываемых со знаком «+», и числа связей
с атомами водорода (или другого более электроположительного элемента),
учитываемых со знаком «-». При этом связи с атомами углерода не учитывают.
В качестве простейшего примера определим степень окисления
углерода в молекуле метанола.
Атом углерода связан с тремя атомами водорода (эти связи
учитываются со знаком « — »), одной связью – с атомом кислорода (ее учитывают
со знаком «+»). Получаем:
-3 + 1 = -2
Таким образом, степень окисления углерода в метаноле равна
-2.
Вычисленная степень окисления углерода хотя и условное
значение, но оно указывает на характер смещения электронной плотности в
молекуле, а ее изменение в результате реакции свидетельствует об имеющем место
окислительно-восстановительном процессе.
Рассмотрим цепочку превращений веществ:
При каталитическом дегидрировании этана получается этилен;
продукт гидратации этилена – этанол; его окисление приведет к этаналю, а затем
– к уксусной кислоте; при ее сгорании образуется углекислый газ и вода.
Определим степени окисления каждого атома углерода в
молекулах перечисленных веществ.
Можно заметить, что в ходе каждого из этих превращений
постоянно меняется степень окисления одного из атомов углерода. В направлении
от этана к оксиду углерода (IV) происходит увеличение
степени окисления атома углерода.
Несмотря на то, что в ходе любых
окислительно-восстановительных реакций происходит как окисление, так и
восстановление, их классифицируют в зависимости оттого, что происходит
непосредственно с органическим соединением (если оно окисляется, говорят о
процессе окисления, если восстанавливается – о процессе восстановления).
Так, в реакции этанола с перманганатом калия этанол будет
окисляться, а перманганат калия – восстанавливается. Реакцию называют
окислением этанола.
Составление окислительно – восстановительных уравнений
Для составления уравнений окислительно- восстановительных
реакций используют как метод электронного баланса, так и метод полуреакций
(электронно — ионный метод). Рассмотрим несколько примеров окислительно-
восстановительных реакций с участием органических веществ [1-3].
1. Горение н-бутана.
Схема реакции имеет вид:
Составим полное уравнение химической реакции методом
баланса.
Среднее значение степени окисления углерода в н-бутане:
10/4 = 2,5.
Степень окисления углерода в оксиде углерода(IV) равна +4.
Составим схему электронного баланса:
C учетом найденных коэффициентов
уравнение химической реакции горения н-бутана будет выглядеть следующим
образом:
Коэффициенты для этого уравнения можно найти и другим
методом, о котором уже упоминалось. Рассчитав степени окисления каждого из
атомов углерода, видим, что они различаются:
В этом случае схема электронного баланса будет выглядеть
так:
Так как в ходе горения н-бутана в его молекулах разрушаются
все химические связи, то в данном случае первый подход вполне оправдан, тем
более что схема электронного баланса, составленная вторым способом, несколько
сложнее.
2. Реакция окисления этилена раствором перманганата калия в
нейтральной среде на холоду (реакция Вагнера).
Расставим коэффициенты в уравнении реакции методом
электронного баланса.
Полное уравнение химической реакции будет выглядеть так:
Для определения коэффициентов можно воспользоваться и методом
полуреакций. Этилен окисляется в этой реакции до этиленгликоля, а перманганат –
ионы восстанавливаются с образованием диоксида марганца.
Схемы соответствующих полуреакций:
Суммарное электронно-ионное уравнение:
3. Реакции окисления глюкозы перманганата калия в кислой
среде.
А. Метод электронного баланса.
Первый вариант
Второй вариант
Рассчитаем степени окисления каждого из атомов углерода в
молекуле глюкозы:
Схема электронного баланса усложняется по сравнению с
предыдущими примерами:
Б. Метод полуреакций в данном случае выглядит следующим
образом:
Суммарное ионное уравнение:
Молекулярное уравнение реакции глюкозы перманганататом
калия:
В органической химии целесообразно использовать определение
окисления как увеличение содержания кислорода или уменьшение содержания
водорода [4]. Восстановление в таком случае определяется как уменьшение
содержания кислорода или увеличение содержания водорода. При таком определении
последовательное окисление органических веществ можно представить следующей
схемой:
или
Практика показывает, что подбор коэффициентов в реакциях
окисления органических веществ вызывает определенные затруднения, так как
приходится иметь дело с весьма непривычными степенями окисления.[4]. Некоторые
учащиеся из-за отсутствия опыта продолжают отождествлять степень окисления с
валентностью и, вследствие этого, неправильно определяют степень окисления
углерода в органических соединениях. Валентность углерода в этих соединениях
всегда равна четырем, а степень окисления может принимать различные значения
(от -3 до +4, в том числе дробные значения). Непривычным моментом при окислении
органических веществ является нулевая степень окисления атома углерода в
некоторых сложных соединениях. Если преодолеть психологический барьер,
составление таких уравнений не представляет сложности, например:
Степень окисления атома углерода в сахарозе равна нулю.
Переписываем схему реакции с указанием степеней окисления атомов, которые их меняют:
Составляем электронные уравнения и находим коэффициенты при
окислителе и восстановителе и продуктах их окисления и восстановления:
Подставим полученные коэффициенты в схему реакции:
Оставшиеся коэффициенты подбираем в такой
последовательности: K

H


уравнение имеет вид:
Многие вузы включают в билеты для вступительных экзаменов
задания по подбору коэффициентов в уравнениях ОВР электронным методом(методом
полуреакций). Если в школе и уделяется хоть какое-то внимание этому методу, то,
в основном при окислении неорганических веществ. Попробуем применить метод
полуреакций для выше приведенного примера окисления сахарозы перманганатом
калия в кислой среде.
Первое преимущество этого метода заключается в том, что нет
необходимости сразу угадывать и записывать продукты реакции. Они достаточно
легко определяются в ходе уравнения. Окислитель в кислой среде наиболее полно
проявляет свои окислительные свойства, например, анион MnO
катион Mn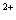
окисляются до CO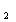
Запишем в молекулярном виде превращения сахарозы:
В левой части не хватает 13 атомов кислорода, чтобы
устранить это противоречие, прибавим 13 молекул H
Левая часть теперь содержит 48 атомов водорода, они
выделяются в виде катионов Н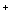
Теперь уравняем суммарные заряды справа и слева:
Схема полуреакций готова. Составление схемы второй полуреакции
обычно не вызывает затруднений:
Объединим обе схемы:
Сократив обе части уравнения на 65 H
240 Н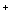
ионное уравнение окислительно-восстановительной реакции:
Упражнения. Расставьте коэффициенты методом
электронного баланса в уравнениях реакций:
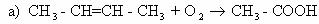
Вариант 1.
Вариант 2.
б) С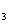

СО

в) СН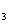

KMnO

СН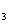

г) С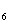
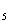
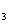



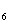
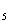
MnSO



д) СН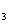
+Н

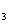

Упражнения. Расставьте коэффициенты методом
электронного баланса:
а) С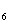
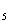

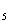


С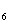
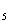




H
12MnO

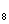
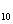


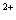
48H
5C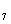
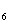


5С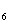
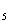

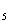



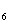
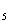





в) C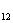
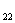
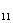


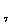
H








г) CH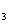


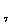








д) СН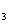






ЛИТЕРАТУРА
1. Матч Дж. Органическая химия. Реакции, механизмы и
структура: В 4т./ Пер. с англ.- М.: Мир, 1987-1988.
2. Карцова А.А, Левкин А. Н. Окислительно-восстановительные
реакции в органической химии // Химия в школе. — 2004. — №2. – С.55-61.
3. Хомченко Г.П., Савостьянова К.И. Окислительно-восстановительные
реакции: Пособие для учащихся . М.- : Просвещение , 1980.
4. Шарафутдинов В. Окислительно-восстановительные реакции в
органической химии // Башкортостан уkытыусыhы. — 2002. — №5. – С.79 -81.
Уравнивание окислительно-восстановительных реакций с участием органических веществ методом электронного баланса.
Реакции окисления органических веществ часто встречаются в базовом курсе химии. При этом, их запись обычно представляется в виде несложных схем, часть из которых дает лишь общее представление о превращениях веществ различных классов друг в друга, не учитывая конкретных условий протекания процесса (например, реакции среды), которые влияют на состав продуктов реакции. Между тем, требования ЕГЭ по химии в части С таковы, что возникает необходимость записи именно уравнения реакции с определенным набором коэффициентов. В данной работе приведены рекомендации по методике составления таких уравнений.
Для описания окислительно-восстановительных реакций применяют два метода: метод электронно-ионных уравнений и метод электронного баланса. Не останавливаясь на первом, отметим, что метод электронного баланса изучается в курсе химии основной школы и поэтому вполне применим для продолжения изучения предмета.
Уравнения электронного баланса прежде всего описывают процессы окисления и восстановления атомов. Кроме этого, специальные множители указывают на коэффициенты перед формулами веществ, содержащих атомы, которые участвовали в процессах окисления и восстановления. Это, в свою очередь, позволяет находить остальные коэффициенты.
Пример 1. Окисление толуола перманганатом калия в кислой среде.
C6H5-CH3 + KMnO4 + H2SO4 = …
Известно, что боковые метильные радикалы аренов обычно окисляются до карбоксила, поэтому в данном случае образуется бензойная кислота. Перманганат калия в кислой среде восстанавливается до двузарядных катионов марганца. Учитывая наличие сернокислотной среды, продуктами будут сульфат марганца (II) и сульфат калия. Кроме того, при окислении в кислой среде образуется вода. Теперь схема реакции выглядит так:
C6H5-CH3 + KMnO4 + H2SO4 = C6H5COOH + MnSO4 + K2SO4 + H2O
Из схемы видно, что изменяется состояние атома углерода в метильном радикале, а также атома марганца. Степени окисления марганца определяются по общим правилам подсчета: в перманганате калия +7, в сульфате марганца +2. Степени окисления атома углерода можно легко определить исходя из структурных формул метильного радикала и карбоксила. Для этого нужно рассмотреть смещение электронной плотности исходя из того, что по электроотрицательности углерод занимает промежуточное положение между водородом и кислородом, а связь С-С формально считается неполярной. В метильном радикале атом углерода притягивает три электрона от трех атомов водорода, поэтому его степень окисления равна -3. В карбоксиле атом углерода отдает два электрона карбонильному атому кислорода и один электрон атому кислорода гидроксильной группы, поэтому степень окисления атома углерода +3.
Уравнение электронного баланса:
Mn+7 + 5e = Mn+2 6
C-3 – 6e = C+3 5
Перед формулами веществ, содержащих марганец необходим коэффициент 6, а перед формулами толуола и бензойной кислоты – 5.
5C6H5-CH3 +6 KMnO4 + H2SO4 = 5C6H5COOH + 6MnSO4 + K2SO4 + H2O
Далее уравниваем число атомов калия:
5C6H5-CH3 +6 KMnO4 + H2SO4 = 5C6H5COOH + 6MnSO4 + 3K2SO4 + H2O
И число атомов серы:
5C6H5-CH3 +6 KMnO4 +9H2SO4 = 5C6H5COOH + 6MnSO4 +3K2SO4 + H2O
На заключительном этапе необходим коэффициент перед формулой воды, который можно вывести подбором по числу атомов водорода или кислорода:
5C6H5-CH3 +6 KMnO4 + H2SO4 = 5C6H5COOH + 6MnSO4 + K2SO4 + 14H2O
Пример 2. Реакция «серебряного зеркала».
Большинство литературных источников указывают, что альдегиды в этих реакциях окисляются до соответствующих карбоновых кислот. При этом окислителем служит аммиачный раствор оксида серебра (I) – Ag2Oамм.р-р. В действительности реакция протекает в щелочной аммиачной среде, поэтому должна образовываться соль аммония или СО2 в случае окисления формальдегида.
Рассмотрим окисление уксусного альдегида реактивом Толленса:
CH3CHO + Ag(NH3)2OH = …
При этом продуктом окисления будет ацетат аммония, а продуктом восстановления – серебро:
CH3CHO + Ag(NH3)2OH = CH3COONH4 + Ag + …
Окислению подвергается атом углерода карбонильной группы. Согласно строению карбонила, атом углерода отдает два электрона атому кислорода и принимает один электрон от атома водорода, т.е. степень окисления углерода +1. В карбоксильной группе ацетата аммония атом углерода отдает три электрона атомам кислорода и имеет степень окисления +3. Уравнение электронного баланса:
C+1 – 2e = C+3 1
Ag+1 + 1e = Ag0 2
Поставим коэффициенты перед формулами веществ, содержащих атомы углерода и серебра:
CH3CHO + 2Ag(NH3)2OH = CH3COONH4 + 2Ag + …
Из четырех молекул аммиака в левой части уравнения, одна будет участвовать в солеобразовании, а три оставшиеся выделяются в свободном виде. Также в составе продуктов реакции будет вода, коэффициент перед формулой которой можно найти подбором (1):
CH3CHO + 2Ag(NH3)2OH = CH3COONH4 + 2Ag + H2O
В заключение отметим, что альтернативный способ описания ОВР – метод электронно-ионных уравнений — при его преимуществах, требует дополнительное учебное время для изучения и отработки, которое, как правило, крайне ограничено. Однако и известный метод электронного баланса при его грамотном использовании приводит к требуемым результатам.
Как определить степень окисления в органических соединениях? Чем отличается определение степени окисления в органических соединениях от определения степени окисления в неорганических? Как составить уравнение окислительно-восстановительной реакции, в которой участвуют соединения углерода, и правильно расставить коэффициенты?
Обо всем этом в данной статье подробно и по порядку.
Содержание:
1. Что такое электроотрицательность, степень окисления и ковалентная связь
2. Как определить степень окисления в органических соединениях: примеры
3. Как расставить коэффициенты в окислительно-восстановительных реакциях с органическими веществами
Проблема, как определить степень окисления в органических соединениях, вытекает из школьного курса химии. Определенное (но не достаточное) внимание уделяется этому вопросу на примере неорганических веществ. Об органических же веществах в этой связи речь практически не идет.
Тем не менее, об окислении соединений углерода в курсе органической химии (10 класс) говорится достаточно часто. 33 задание в ЕГЭ по химии практически всегда подразумевает хотя бы одну ОВР с участием органического вещества и необходимость не только составить схему реакции, но и расставить коэффициенты.
Придя в колледж или университет, изучая курс органической химии на более серьезном уровне, студент сталкивается все с той же проблемой: как определить степень окисления в органических соединениях. Подразумевается, что бывший выпускник школы получил эти знания в школьном курсе химии, поэтому нет надобности останавливаться на данном вопросе в профессиональном образовании.
Налицо потеря взаимосвязи и преемственности разных ступеней образования: среднего основного и профессионального (СПО и ВПО).
Итак, разберемся по порядку как определить степень окисления в органических соединениях.
Что такое электроотрицательность, степень окисления и ковалентная связь
Для того чтобы правильно определить степень окисления в органическом соединении, необходимо четко и ясно усвоить три основных понятия: собственно само понятие степень окисления, электроотрицательность и ковалентная связь.
Остановимся на них кратко, так как их рассмотрение не является основной целью данной статьи.
Что такое электроотрицательность
Понятие электроотрицательности (ЭО) впервые было введено американским химиком Л.Полингом в 1932 г.
Кстати, ЭО – это еще одна относительная величина в химии. Ее правильнее называть относительной электроотрицательностью (ОЭО). Абсолютные значения ЭО очень не удобны в расчетах, поэтому их вычисляют относительно значения ЭО лития Li. Относительные величины не имеют единиц измерения.
Были получены вполне приемлемые для расчетов и анализа числа, которые сведены в удобную таблицу, в общих чертах похожую на периодическую систему химических элементов.
Способность атомов химических элементов притягивать к себе электроны других атомов в процессе образования химической связи называется электроотрицательностью.
Почему нейтральные атомы притягиваются
Раз атомы притягивают к себе электроны, то закономерно возникает следующий вопрос. Если атом, по определению, – это электронейтральная частица, то как он может вообще к себе что-то притягивать, в частности электроны – отрицательно заряженные частицы?
Вообще этот вопрос можно бы переадресовать ученым, специалистам, занимающимся проблемами квантовой механики (один из разделов современной физики).
А мы же лишь крайне упрощенно поясним, почему такое может быть.
Необходимо вспомнить, что силовые линии электрического поля положительного заряда (а им является ядро атома) всегда заканчиваются на отрицательном заряде (электроны атома).
У атомов большинства химических элементов внешний уровень не завершен. То есть в нем есть своеобразная «дырка», сквозь которую выходят силовые линии ядра. Выходят они за пределы атома и заканчиваются на электронах другого атома. В подобной ситуации, несмотря на свою общую электронейтральность, атом ведет себя как положительная частица.
Примерно так это выглядит
При всем при этом атомы полностью не «слипаются». Это не возможно, так как положительно заряженные ядра атомов будут отталкиваться. Но поскольку расстояние между ядром одного атома и электронами другого меньше расстояния между ядрами, то можно утверждать, что силы притяжения все-таки преобладают над силами отталкивания.
Для чего необходимо понятие относительной электроотрицательности
Знание и понимание понятия ОЭО дает возможность определить тип химической связи между атомами. Для этого необходимо найти разность ОЭО двух элементов, атомы которых и образуют связь.
Если разность электроотрицательностей менее 0,5, то связь считается ковалентной неполярной. При разности от 0,5 до 1,6 – связь ковалентная полярная. Если более 2,0 – ионная. А если разность в промежутке от 1,6 до 2,0, то в присутствии металла связь считается ионной, при его отсутствии – ковалентной полярной.
Что такое ковалентная связь
Почему мы говорим здесь о ковалентной связи? Потому, что большинство органических соединений – ковалентные. А это очень важно при определении с.о. углерода в них.
Если коротко, то
ковалентная связь – связь между атомами элементов, возникающая за счет обобществления электронов, т.е. образования общих электронных пар.
Если связь образована между атомами с одинаковой ОЭО, то связь будет считаться ковалентной неполярной. Это потому, что между атомами не происходит перераспределения электронной плотности. Иными словами обобществленная электронная пара не смещается к какому-либо атому.
Такая ситуация возможна, если в образовании связи участвуют атомы одного и того же химического элемента-неметалла:
Но есть и редкие исключения. Молекула фосфина PH3 характеризуется ковалентной неполярной связью, так как относительные электроотрицательности водорода и фосфора равны: ОЭО(Н)=2,1 и ОЭО(Р)=2,1.
Если же связь образована элементами-неметаллами с разной ОЭО, то она считается ковалентной полярной. Происходит перераспределение электронной плотности между атомами, т.е. общая электронная пара смещается к атому с большей ОЭО. И чем сильнее будет разность в электроотрицательностях атомов элементов, тем полярнее будет и связь.
И еще одно понятие, связанное с ковалентностью, – это валентность, означающая количество общих электронных пар (или иными словами, количество связей между атомами).
Что такое степень окисления и какие значения она может принимать
Степень окисления (с.о.) – важнейшее понятие в теории окислительно-восстановительных процессов. И это условная величина.
Известно, что при образовании ковалентной связи электроны общей электронной пары смещаются к атому более электроотрицательного элемента. Но лишь смещаются, а не полностью переходят к нему!
В итоге на более электроотрицательном атоме возникнет частичный (точнее дробный) отрицательный заряд (δ-), например, -0,73, -2/3 и т.п. А на менее электроотрицательном атоме – частичный положительный (δ+) заряд. Такими дробными числами крайне неудобно пользоваться при вычислениях и составлении формул веществ.
Классифицировать с.о. можно по разным признакам. Один из них – это постоянство для одного и того же химического элемента.
Согласно данному признаку, существуют элементы, проявляющие во всех без исключения сложных веществах одну и ту же (постоянную) степень окисления. Например:

А вот теперь самое интересное! Мы прекрасно знаем, что химический элемент углерод проявляет две степени окисления: +2 (в соединении СО) и +4 (СО2, например).
И настолько прочно это закрепляется в сознании, что мы и не предполагаем, что на самом деле у углерода может быть весь спектр степеней окисления от -4 до +4.
Более того, находясь в составе сложного органического соединения, углерод может иметь и нулевую степень окисления! Уж это совсем не вяжется с устоявшимися представлениями, выработанными на основе знаний о неорганических веществах. Для них мы знаем, что с.о. равная нулю возможна у атомов элементов в составе простых веществ (О3, P4, H2, N2 и т.д.)
Подведем некоторый итог.
В органических соединениях:
1) с.о. углерода принимает значения от -4 до +4;
2) с.о. углерода может быть равна 0;
3) валентность углерода постоянна, равна IV и не всегда совпадает по значению со степенью окисления.
Как определить степень окисления в органических соединениях: примеры
Методы, которыми мы пользуемся для определения с.о. в неорганических веществах, применимы к органическим лишь в очень редких случаях.
Напомним, что при этом мы всегда исходим из положения, что молекула вещества электронейтральна, то есть алгебраическая сумма всех зарядов (степеней окисления), как положительных, так и отрицательных, внутри нее равна нулю. Например:


Особенности определения с.о. в органических веществах
Определить степень окисления в органических веществах можно разными способами. Разберем самый простой и удобный, на наш взгляд. Именно для этого мы вспомнили, что такое относительная электроотрицательность, ковалентная связь и ее виды.
Вернемся к ранее упомянутому пропану С3Н8 и рассмотрим, какие виды ковалентной связи присутствуют в его молекуле.
Для этого:
1) запишем полную структурную формулу вещества и пронумеруем атомы углерода;
2) определим, какие связи в молекуле будут ковалентными полярными и ковалентными неполярными;
3) для ковалентных полярных связей покажем смещение общей электронной пары с помощью стрелки (так как ОЭО(С) > ОЭО(Н), то смещение происходит от Н к С);



Но даже и такой вполне удобный способ определения с.о. не всегда бывает справедлив. Все дело во влиянии атомов кислорода на распределение зарядов в молекуле.
Например, если применять указанный выше способ к определению с.о. углерода в молекуле метанола, то можно ожидать, что она буде равна -3. Однако это не так. В данной молекуле углерод имеет с.о. -2.
Молекулу метанола можно рассматривать как связанные между собой метильную –СН3 и гидроксильную –ОН группы. В таком случае суммарные заряды каждой из них в итоге должны дать ноль, так как молекула в целом электронейтральна.
Атом кислорода, как самый электроотрицательный в молекуле метанола, оттягивает к себе электронные плотности связей С-О и Н-О, принимая с.о. -2. Таким образом, суммарный заряд гидроксильной –ОН группы равен -1. Тогда суммарный заряд метильной –СН3 группы должен быть равен +1. А такое возможно только в том случае, если атом углерода имеет с.о. -2.
Ясно, что подобная ситуация будет возникать всегда в тех случаях, когда атом углерода связан с гидроксильной –ОН группой, образуя первичный спирт.
Нечто подобное происходит со степенью окисления углерода в молекуле диметилового эфира. Здесь также можно ожидать с.о. углерода -3. Но она равна -2 на обоих атомах.
Молекула диметилового эфира – это две метильные группы, связанные через атом кислорода (его с.о. -2). Каждая –СН3 должна иметь суммарный заряд +1. Это возможно в случае с.о. углерода -2.
Приведем другие примеры.
Метилэтиловый эфир – последовательно связанные друг с другом метильная группа –СН3, атом кислорода О, гомологическая разность –СН2– и еще одна метильная группа –СН3.
Таким образом, с. о. углерода в молекуле метилэтилового эфира: -2, -1, -3.
Степень окисления углерода в молекуле уксусного альдегида принимает значения -3 и +1:



Приведенные примеры позволяют сделать общие выводы о том, как определить степень окисления в органических соединениях.
1) Каждая ковалентная полярная связь, электронная плотность которой смещается К атому углерода (Н→С), добавляет в значение его с.о. -1.
2) Каждая ковалентная полярная связь, электронная плотность которой смещается ОТ атома углерода (С→О, С→N и т.д.), добавляет в его значение с.о. +1.
3) Определяя конечное значение с.о. углерода, необходимо посчитать количество смещенных ОТ него и К нему связей с учетом знака (+ или -).
! При этом не следует забывать о влиянии более электроотрицательных атомов на распределение электронной плотности (а, значит, и зарядов), что приводит в некоторых случаях к несоблюдению указанных общих выводов.
Как расставить коэффициенты в окислительно-восстановительных реакциях с органическими веществами
Существует два основных метода составления схемы ОВР и подбора коэффициентов в таких реакциях: метод электронного баланса и ионно-электронный метод (полуреакций). Каждый из них удобнее использовать в той или иной ситуации. В данной статье мы не рассматриваем суть этих методов, а останавливаемся на применении их к ОВР с участием органических веществ.
Итак, начнем с самых простых окислительно-восстановительных реакций, в которых реагентами выступают органические соединения. Для определения степени окисления углерода будем использовать выше описанный метод. В каждом конкретном примере на этом останавливаться уже не будем.
Пример 1. СН4 + О2 → СО2 + Н2О
При расстановке коэффициентов в данном случае лучше воспользоваться методом электронного баланса:
1) определим с.о. элементов;
2) составим схемы полуреакций с элементами, изменяющими свою с.о.;
3) используя данные по числу отданных и принятых электронов в полуреакциях, найдем наименьшее общее кратное и определим множители для каждой из полуреакций;
4) просуммируем полуреакции с учетом найденных множителей (коэффициентов);
5) перенесем коэффициенты в схему реакции, поставив их перед соответствующими веществами;
6) подберем коэффициенты для всех остальных химических элементов;
7) помним, что баланс количества атомов кислорода проверяем в последнюю очередь. Обычно, если число атомов кислорода слева (до стрелки) и справа (после стрелки) сходится, то это означает, что реакция составлена правильно и все остальные коэффициенты верны.
Пример 2. С3Н8 + О2 → СО2 + Н2О
В данном случае также удобнее использовать метод электронного баланса.
Расстановку коэффициентов проводим, как и в предыдущем случае. Однако есть некоторый нюанс. После определения с.о. углерода в пропане обнаруживаем, что их две: -2 и -3. Поэтому составленных схем полуреакций для углерода будет две.
Пример 3. Н2C2O4 + KMnO4 → СО2 + K2CO3 + MnO2 + Н2О
Для расстановки коэффициентов вновь воспользуемся методом электронного баланса.
Пример 4. CH3OH + K2Cr2O7 + H2SO4 → HCOOH + Cr2(SO4)3 + K2SO4 + Н2О
В данном случае метанол и дихромат калия реагируют в кислой среде. Для расстановки коэффициентов можно воспользоваться любым из методов. Еще раз применим метод электронного баланса.
Пример 5. C6H12O6 + KMnO4 + H2SO4 → CO2 + MnSO4 + K2SO4 + Н2О
Расставим коэффициенты тремя разными способами.
Способ 1. В молекуле глюкозы степень окисления углерода -1, 0 и +1. Примем, что средняя с.о. равна 0. Имейте ввиду, что такой подход не всегда и не для всех веществ будет оправдан. В данном случае это вполне возможно.
Способ 2. Расставим коэффициенты методом электронного баланса, используя все три с.о. углерода.
Способ 3. Поскольку реакция между глюкозой и перманганатом калия проходит в кислой среде (в H2SO4), расставим коэффициенты ионно-электронным методом (полуреакций):
1) молекулярные вещества (а к ним относится и глюкоза) на ионы не диссоциируют, поэтому в схемах полуреакций записываются в исходном виде;
2) количество недостающих кислорода и водорода в полуреакциях компенсируем, дописывая по необходимости молекулы воды H2O или ионы водорода Н+;
3) считаем слева и справа в каждой полуреакции суммарный заряд (он создается ионами, образовавшимися при диссоциации реагирующих веществ, и ионами водорода Н+);
4) разницу зарядов компенсируем отдаваемыми или принимаемыми электронами;
5) так же, как и в методе электронного баланса, находим наименьшее общее кратное, определяем множители для каждой из полуреакций;
6) просуммируем полуреакции с учетом найденных множителей (коэффициентов);
7) перенесем коэффициенты в схему реакции, поставив их перед соответствующими веществами;

9) помним, что баланс количества атомов кислорода проверяем в последнюю очередь.
Пример 6. C3H4 + KMnO4 + H2SO4 → CH3COOH + CO2 + MnSO4 + K2SO4 + Н2О
В исходном веществе C3H4 (пропин) степени окисления углерода принимают значения -3, -1 и 0. В образовавшейся уксусной кислоте CH3COOH: -3 и +3. Кроме того, в углекислом газе CO2 с.о. углерода равна +4.
Такое разнообразие степеней окисления одного элемента затрудняет применение метода электронного баланса. Поэтому лучше воспользоваться методом полуреакций.
Действие окислителей на органические вещества
В зависимости от строения и состава органических веществ (разветвленность углеродного скелета, наличие функциональных групп и их количество), а также от условий процесса (избыток или недостаток окислителя, его концентрация, рН раствора, нагревание или охлаждение) окисление происходит по-разному.
Так, например, при окислении алкена раствором KMnO4 в мягких условиях (без нагревания и в нейтральной или слабощелочной среде) образуется двухатомный спирт. А при окислении алкена раствором KMnO4 в жестких условиях (с нагреванием и в кислой или сильнощелочной среде) молекула по двойной связи разрушается, и образуются совершенно иные продукты. Это могут быть и карбоновая кислота, и ее соль и СО2.
Знание действия окислителей на органические вещества тех или иных классов поможет верно определить продукты окислительно-восстановительной реакции и правильно расставить в них коэффициенты.
Итак, ответ на вопрос: «Как определить степень окисления в органических веществах», – позволяет правильно составить схему реакции с участием органических веществ и подобрать наиболее оптимальный метод расстановки коэффициентов.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Теория ОВР в органической химии
Окисление
органических веществ. Зависимость продуктов реакции окисления органических
веществ от среды. Применение метода электронного баланса в органических реакциях.
Окислительно-восстановительные
реакции с участием органических веществ встречаются в заданиях С3 и вызывают
наибольшие затруднения у школьников. Как правило, большинство выпускников
пишут схемы окислительно-восстановительных реакций, показывая окислитель [O], не
указывая продукты ОВР, кроме основного; вызывает затруднение и расстановка
коэффициентов в органических ОВР.
Мы
рассмотрим:
1. Графический
метод определения степени окисления в органических веществах;
2. Окислительно-восстановительные
реакции с участием органических веществ, их разновидности, определение
продуктов;
3. Метод
макроподстановки при расставлении коэффициентов в органических ОВР
1. Графический метод определения степени окисления в органических
веществах
В
органических веществах можно определять степени окисления элементов алгебраическим
методом, при этом получается усредненное значение степени окисления.
Этот метод наиболее применим в том случае, если все атомы углерода
органического вещества по окончании реакции приобрели одинаковую степень
окисления (реакции горения или полного окисления)
Рассмотрим
такой случай:
Пример
1.
Обугливание дезоксирибозы серной концентрированной кислотой с дальнейшим
окислением:
С5Н10О4
+ H2SO4 ® CO2 + H2O + SO2
Найдём степень
окисления углерода х в дезоксирибозе: 5х + 10 – 8 = 0; х = — 2/5
В электронном
балансе учитываем все 5 атомов углерода:
5С -2/5 –
22е ® 5С+4 2 1
Окисление
S+6 + 2е ® S+4 22
11
восстановление
С5Н10О4
+ 11H2SO4 ® 5CO2 + 16H2O + 11SO2
В
большинстве случаев окислению подвергаются не все атомы органического вещества,
а только некоторые. В этом случае в электронный баланс вносятся только атомы,
изменившие степень окисления, а, следовательно, нужно знать степень окисления
каждого атома. Легче всего это сделать графическим методом:
1) изображается полная структурная формула вещества;
2) по каждой связи
стрелкой показывается смещение электрона к наиболее электроотрицательному
элементу;
3) все связи С – С
считаются неполярными;
4) далее ведется
подсчет: сколько стрелок направлено к атому, столько «–» , сколько от атома –
столько «+». Сумма «–» и «+» определяет степень окисления атома. Рассмотрим
несколько примеров:
Н
Н
С С О
Н О Н
Углерод
карбоксильной группы смещает от себя 3 электрона, его степень окисления +3,
углерод метильного радикала притягивает к себе 3 электрона от водорода, его
степень окисления – 3.
Cl
Н
С С О
H
H
Углерод
альдегидной группы отдает 2 электрона (+2) и притягивает к себе 1 электрон ( —
1), итого степень окисления углерода альдегидной группы +1. Углерод радикала
притягивает 2 электрона от водорода (-2) и отдает 1 электрон хлору (+1), итого
степень окисления этого углерода -1.
Н Н
Н
С С С ≡ С Н
Н
Н
У первого углерода
(начинаем считать справа) степень окисления -1, у второго 0, так как мы считаем
все связи углерод-углерод неполярными, у третьего – 2, у четвертого – 3.
2.
Окислительно-восстановительные реакции с участием органических веществ, их
разновидности, определение продуктов
Все
ОВР в органике можно условно разделить на 3 группы:
1. Полное
окисление и горение. В качестве окислителей используются
кислород (другие вещества, поддерживающие горение, например оксиды азота),
концентрированные азотная и серная кислота, можно использовать твердые соли,
при нагревании которых выделяется кислород (хлораты, нитраты, перманганаты и
т.п.), другие окислители (например, оксид меди (II)). В
этих реакциях наблюдается разрушение всех химических связей в органическом
веществе. Продуктами окисления органического вещества являются углекислый газ и
вода.
2. Мягкое
окисление.
В этом случае не происходит разрыва углеродной цепи. К мягкому окислению
относится окисление спиртов до альдегидов и кетонов, окисление альдегидов до
карбоновых кислот, окисление алкенов до двухатомных спиртов (Реакция Вагнера),
окисление ацетилена до оксалата калия, толуола – до бензойной кислоты и т.д. В
качестве окислителей в этих случаях используются разбавленные растворы
перманганата калия, дихромата калия, азотной кислоты, аммиачный раствор оксида
серебра, оксид меди (II), гидроксид
меди (II).
Пример
2.
Окисление этилена водным раствором перманганата калия при обычных условиях
(реакция Вагнера) :
CH2=CH2
+ KMnO4 + H2O ®
HO-CH2-CH2-OH + MnO2 + KOH
Степень
окисления углерода в этилене – 2, в этиленгликоле – 1. В балансе учитываем оба
атома углерода, так как они соединены неполярной связью.
2С -2 – 2е ® 2С-1 3
восстановитель
Окисление
Mn+7 + 3е ® Mn+4 2
окислитель
Восстановление
3CH2=CH2 + 2KMnO4 + 4H2O ® 3HO—CH2—CH2—OH + 2MnO2 + 2KOH
Пример
3.
Окисление этаналя подкисленным раствором перманганата калия при нагревании :
CH3-CHО + KMnO4 +
H2SO4 ®
CH3-COOH + MnSO4+ K2SO4 + H2O
Степень окисления
углерода в альдегидной группе +1, в карбоксильной группе +3, это используем в
балансе, метильный радикал в реакции не участвовал, его не имеет смысла учитывать.
С +1 – 2е ® С+3 5 восстановитель
Окисление
Mn+7 + 5е ® Mn+2 2
окислитель
Восстановление
5CH3-CHО + 2KMnO4 + 3H2SO4 ® 5CH3-COOH
+ 2MnSO4+ K2SO4
+ 3H2O
3. Деструктивное
окисление.
Происходит в более жестких условиях, чем мягкое окисление, сопровождается
разрывом некоторых углерод-углеродных связей. В качестве окислителей
используются более концентрированные растворы перманганата калия, дихромата
калия при нагревании. Среда этих реакций может быть кислой, нейтральной и
щелочной. От этого будут зависеть продукты реакций.
Деструкция
(разрыв углеродной цепи) происходит у алкенов и
алкинов – по кратной связи, у производных бензола – между первым и вторым
атомами углерода, если считать от кольца, у третичных спиртов – у атома,
содержащего гидроксильную группу, у кетонов – у атома при карбонильной группе. Если
при деструкции оторвался фрагмент, содержащий 1 атом углерода, то он
окисляется до углекислого газа (в кислой среде), гидрокарбоната и (или)
карбоната (в нейтральной среде), карбоната (в щелочной среде). Все более
длинные фрагменты превращаются в кислоты (в кислой среде) и соли этих кислот (в
нейтральной и щелочной среде). В некоторых случаях получаются не кислоты, а
кетоны (при окислении третичных спиртов, разветвленных радикалов у гомологов
бензола, у кетонов, алкенов).
Ниже в
схемах представлены возможные варианты окисления производных бензола в кислой и
щелочной среде. Разными цветами выделены атомы углерода, участвующие в
окислительно-восстановительном процессе. Выделение цветом позволяет проследить
«судьбу» каждого атома углерода.
Схема 1. Окисление производных бензола в кислой среде
Схема 2. Окисление производных бензола в щелочной среде
Несколько сложнее составить уравнение реакции окисления в нейтральной
среде. Точно определить, какие продукты получатся, можно только при
расстановке коэффициентов. Рассмотрим последовательно такой случай.
Пример 4. Окисление фенилацетилена
водным раствором перманганата калия при нагревании. При этой реакции происходит
деструкция по тройной связи, образуется бензоат калия, оксид марганца (IV),
остальные продукты пока не ясны, запишем КОН и КНСО3. Кстати, при
расстановке коэффициентов может выясниться, что воду нужно перенести в правую
часть уравнения:
С6Н5—С≡СН
+
KMnO4 + H2O ® С6Н5—СООК + MnO2 + KOH+ КНСО3
С 0 –
3е ® С+3
С -1–
5е ® С+4 8 3 восстановитель
Окисление
Mn+7 + 3е ® Mn+4 8
окислитель
Восстановление
Ставим коэффициенты из баланса перед
углеродом и марганцем:
3С6Н5—С≡СН
+
8KMnO4 + H2O ® 3С6Н5—СООК + 8MnO2 + KOH+ 3КНСО3
После
этого уравниваем калий:
3С6Н5—С≡СН
+
8KMnO4 + H2O ® 3С6Н5—СООК + 8MnO2 + 2KOH+ 3КНСО3
Учитывая то, что кислая соль
нейтрализуется щелочью:
2KOH+ 3КНСО3
® 2К2СО3
+ КНСО3 + 2H2O, изменим
продукты реакции:
3С6Н5—С≡СН
+
8KMnO4 + H2O ® 3С6Н5—СООК + 8MnO2 + 2К2СО3 + КНСО3
Проверим число
атомов водорода в правой части уравнения – 16, в левой части
– 18 без учета воды, следовательно, воду нужно перенести в
правую часть:
3С6Н5—С≡СН
+
8KMnO4 ® 3С6Н5—СООК + 8MnO2 + 2К2СО3 + КНСО3+
H2O
Пример
5. Окисление бутена-1 водным раствором перманганата калия при
нагревании. При этой реакции происходит деструкция по двойной связи, образуется
пропионат калия, оксид марганца (IV),
остальные продукты пока не ясны, запишем КОН и КНСО3.
CH3—CH2—CH=CH2
+ KMnO4 + H2O ® С2Н5—СООК + MnO2 + KOH+ КНСО3
С -1 –
4е ® С+3
С -2 –
6е ® С+4 10 3 восстановитель
Окисление
Mn+7 + 3е ® Mn+4 10
окислитель
Восстановление
Ставим коэффициенты из баланса перед
углеродом и марганцем:
3CH3—CH2—CH=CH2
+ 10KMnO4 + H2O ® 3С2Н5—СООК + 10MnO2 + KOH+ 3КНСО3
После этого уравниваем калий:
3CH3—CH2—CH=CH2
+ 10KMnO4 + H2O ® 3С2Н5—СООК + 10MnO2 + 4KOH+ 3КНСО3
Учитывая то, что кислая соль нейтрализуется щелочью:
4KOH+ 3КНСО3
® 3К2СО3
+ КOH + 3H2O, изменим
продукты реакции:
3CH3—CH2—CH=CH2
+ 10KMnO4 + H2O ® 3С2Н5—СООК + 10MnO2 + KOH+ 3К2СО3
Проверим число
атомов водорода в правой части уравнения – 16, в левой части
– 24 без учета воды, следовательно, воду нужно перенести в
правую часть:
3CH3—CH2—CH=CH2
+ 10KMnO4 ® 3С2Н5—СООК + 10MnO2 + KOH+ 3К2СО3 +
4H2O
3. Метод
макроподстановки при расставлении коэффициентов в органических ОВР
В случае, когда
множество атомов углерода меняют степень окисления, рассматривается каждый атом
отдельно, а затем все отданные атомами углерода электроны складываются. В этом
и состоит сущность макроподстановки. Рассмотрим пример
6. Пользуясь схемой 1, составим формулы продуктов реакции
окисления.

KMnO4 + H2SO4 ®

CO2 + CH3COOH
+ MnSO4 + K2SO4
+ H2O
Теперь
определим степени окисления всех атомов углерода, которые будут меняться: в
гидроксильной группе – 1, в альдегидной группе +1, в метильном радикале – 3, в
этильном радикале будет менять степень окисления только атом, связанный с СН,
его степень окисления – 2, в СН степень окисления С – 1. Первые от бензольного
кольца атомы углерода приобрели степень окисления +3, метильный радикал
превратился в углекислый газ +4, углерод этильного радикала – в карбоксильную
группу +3.
С -1 –
4е ® С+3
С
+1 – 2е ® С+3
С -1 –
4е ® С+3 22
5
С
-3 – 7е ® С+4
С -2 –
5е ® С+3
Окисление
Mn+7 + 5е ® Mn+2 22
окислитель
Восстановление
ИЛИ
С -1 +С +1 +С -1
+С -3 +С -2 –
22 е ®
4С+3 + С+4
— 6
е +16 е
Расставим коэффициенты (органические вещества записаны в
виде молекулярных формул, но так записывать не обязательно)
5С12Н16О2+ 22KMnO4 + 33H2SO4 ® 5С9Н6О6
+ 5CO2 + 5CH3COOH
+ 22MnSO4 + 11K2SO4
+ 38H2O
Задание
4.
1) Составьте
уравнение реакции деструктивного окисления по обеим двойным связям 4-метилпентадиена
– 1,3 подкисленным раствором перманганата калия при нагревании.
2) Составьте
уравнение реакции окисления стирола водным раствором перманганата калия при
нагревании.
3) Составьте
уравнение реакции окисления 1-изопропил-3-метил-2-пропил-5-этилбензола щелочным
раствором перманганата калия при нагревании.
Для
расставления коэффициентов используйте метод макроподстановки.