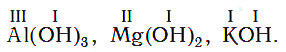Основания

4.5
Средняя оценка: 4.5
Всего получено оценок: 2547.
4.5
Средняя оценка: 4.5
Всего получено оценок: 2547.
Один из классов сложных неорганических веществ – основания. Это соединения, включающие атомы металла и гидроксильную группу, которая может отщепляться при взаимодействии с другими веществами.
Строение
Основания могут содержать одну или несколько гидроксо-групп. Общая формула оснований – Ме(ОН)х. Атом металла всегда один, а количество гидроксильных групп зависит от валентности металла. При этом валентность группы ОН всегда I. Например, в соединении NaOH валентность натрия равна I, следовательно, присутствует одна гидроксильная группа. В основании Mg(OH)2 валентность магния – II, Al(OH)3 валентность алюминия – III.
Количество гидроксильных групп может меняться в соединениях с металлами с переменной валентностью. Например, Fe(OH)2 и Fe(OH)3. В таких случаях валентность указывается в скобках после названия – гидроксид железа (II), гидроксид железа (III).
Физические свойства
Характеристика и активность основания зависит от металла. Большинство оснований – твёрдые вещества белого цвета без запаха. Однако некоторые металлы придают веществу характерную окраску. Например, CuOH имеет жёлтый цвет, Ni(OH)2 – светло-зелёный, Fe(OH)3 – красно-коричневый.
Виды
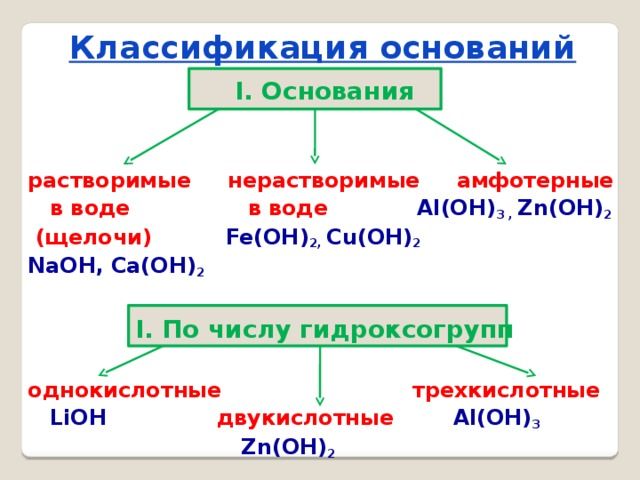
Основания классифицируются по двум признакам:
- по количеству групп ОН – однокислотные и многокислотные;
- по растворимости в воде – щёлочи (растворимые) и нерастворимые.
Щёлочи образуются щелочными металлами – литием (Li), натрием (Na), калием (K), рубидием (Rb) и цезием (Cs).
Кроме того, к активным металлам, образующим щёлочи, относят щелочноземельные металлы – кальций (Ca), стронций (Sr) и барий (Ba). Эти элементы образуют следующие основания:
- LiOH;
- NaOH;
- KOH;
- RbOH;
- CsOH;
- Ca(OH)2;
- Sr(OH)2;
- Ba(OH)2.
Все остальные основания, например, Mg(OH)2, Cu(OH)2, Al(OH)3, относятся к нерастворимым.
По-другому щёлочи называются сильными основаниями, а нерастворимые – слабыми основаниями. При электролитической диссоциации щёлочи быстро отдают гидроксильную группу и быстрее вступают в реакцию с другими веществами. Нерастворимые или слабые основания менее активные, т.к. не отдают гидроксильную группу.
Особое место в систематизации неорганических веществ занимают амфотерные гидроксиды. Они взаимодействуют и с кислотами, и с основаниями, т.е. в зависимости от условий ведут себя как щёлочь или как кислота. К ним относятся Zn(OH)2, Al(OH)3, Pb(OH)2, Cr(OH)3, Be(OH)2 и другие основания.
Получение
Основания получают различными способами. Самый простой – взаимодействие металла с водой:
Ba + 2H2O → Ba(OH)2 + H2.
Щёлочи получают в результате взаимодействия оксида с водой:
Na2O + H2O → 2NaOH.
Нерастворимые основания получаются в результате взаимодействия щелочей с солями:
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4.
Химические свойства
Основные химические свойства оснований описаны в таблице.
|
Реакции |
Что образуется |
Примеры |
|
С кислотами |
Соль и вода. Нерастворимые основания взаимодействуют только с растворимыми кислотами |
Cu(OH)2↓ + H2SO4 → CuSO4 +2H2O |
|
Разложение при высокой температуре |
Оксид металла и вода |
2Fe(OH)3 → Fe2O3 + 3H2O |
|
С кислотными оксидами (реагируют щёлочи) |
Соль |
NaOH + CO2 → NaHCO3 |
|
С неметаллами (вступают щёлочи) |
Соль и водород |
2NaOH + Si + H2O → Na2SiO3 +H2↑ |
|
Обмена с солями |
Гидроксид и соль |
Ba(OH)2 + Na2SO4 → 2NaOH + BaSO4↓ |
|
Щелочей с некоторыми металлами |
Сложная соль и водород |
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ |
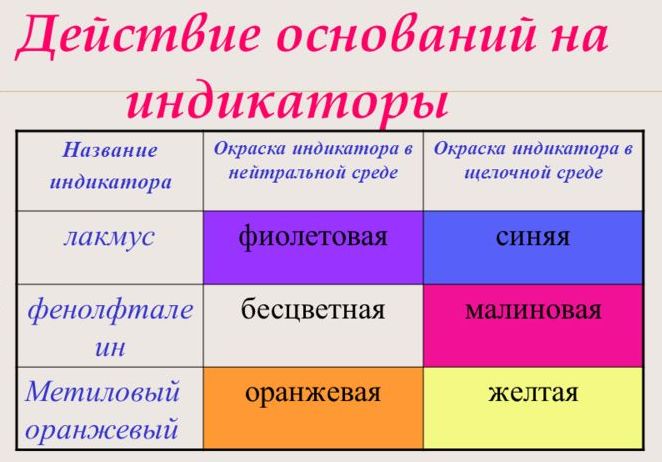
С помощью индикатора проводится тест на определение класса основания. При взаимодействии с основанием лакмус становится синим, фенолфталеин – малиновым, метилоранж – жёлтым.
Что мы узнали?
Из урока 8 класса химии узнали об особенностях, классификации и взаимодействии оснований с другими веществами. Основания – сложные вещества, состоящие из металла и гидроксильной группы ОН. Они делятся на растворимые или щёлочи и нерастворимые. Щёлочи – более агрессивные основания, быстро реагирующие с другими веществами. Основания получают при взаимодействии металла или оксида металла с водой, а также в результате реакции соли и щёлочи. Основания реагируют с кислотами, оксидами, солями, металлами и неметаллами, а также разлагаются при высокой температуре.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Никита Ковалёв
9/10
-
Еркежан Рысова
10/10
-
Александр Котков
10/10
-
Мишлен Громов
10/10
-
Вика Мартынова
10/10
-
Ольга Хромцова
10/10
-
Лилия Швец
10/10
-
Наталья Чернова
10/10
-
Максим Макеев
10/10
-
Сергей Ефремов
8/10
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 2547.
А какая ваша оценка?
Методическая
разработка:
«Алгоритм
составления названий и формул оснований (гидроксидов)»
При изучении химии в 8 классе учащиеся
сталкиваются с затруднениями в названии химических веществ и составления формул
химических соединений. Для лучшего усвоения данного материала им помогут
«Алгоритмы» — краткая запись последовательности действий.
АЛГОРИТМ
СОСТАВЛЕНИЯ НАЗВАНИЙ ОСНОВАНИЙ.
Основания — сложные химические вещества ,
состоящие из ионов металла связанных с гидроксогруппой (-ОН)
При названии оснований необходимо соблюдать
данную последовательность действий:
1. Дается
название последней части вещества – гидроксид.
2. Называется
металл, который связан с гидроксогруппой (-ОН), в родительном падеже (записан
перед гидроксогруппой).
3. Если
заряд металла переменный, в скобках указывается валентность металла.
Запомните: количество
гидроксогрупп равно заряду и валентности металла.
ПРИМЕР:
Fe( OH)2
гидроксид железа (ii)
Al(OH)3
гидроксид алюминия
АЛГОРИТМ
СОСТАВЛЕНИЯ ФОРМУЛ ОСНОВАНИЙ.
1.
Записываются символы металла и гидроксогруппы
(-ОН).
2.
Указывается заряд металла.
3.
Записывается индекс для гидроксогруппы. Если
заряд металла больше 1, гидроксогруппу заключают в скобки. Индекс указывается
за скобками.
ПРИМЕР:
Гидроксид
алюминия гидроксид меди (II)
1. Al OH
1.
Cu
OH
2. 3+
2.
2+
Al OH
Cu OH
3. Al
(OH)3
3. Cu
(OH)2
В уроке 29 «Понятие об основаниях» из курса «Химия для чайников» познакомимся с новым классом химических веществ — основаниями, а также узнаем о новом типе химических реакций — реакциях обмена.
Как вы уже знаете, при взаимодействии активных металлов и их оксидов с водой образуются основания — соединения, не принадлежащие ни к одному из известных вам до сих пор классов: оксидов, солей или кислот.
Основания как сложные вещества
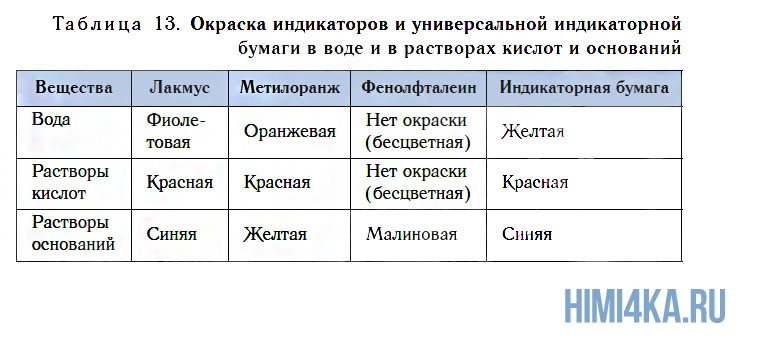
Испытаем с помощью индикатора раствор, полученный в результате реакции оксида кальция CaO с водой. Для этого прибавим к нему 1—2 капли раствора метилового оранжевого. Окраска раствора изменится с оранжевой на желтую (рис. 111).
Это свидетельствует о том, что в полученном растворе присутствует не кислота, а какое-то новое вещество, изменяющее цвет индикатора. Подобно оксиду кальция, с водой реагируют и некоторые другие оксиды, например оксид натрия Na2O:
В результате взаимодействия оксидов кальция и натрия с водой образуются вещества Са(ОН)2 и NaОН. Они похожи тем, что в их состав входят атомы металлов и группы ОН, называющиеся гидроксогруппами (от греческого слова «hydor», которое означает «вода»). Такие вещества относятся к классу оснований.
Основания — сложные вещества, состоящие из атомов металлов и гидроксогрупп.
Валентность гидроксогруппы равна единице. Зная это, легко составить формулу любого основания: число групп ОН в формуле основания всегда равно валентности атома металла, например:
В то же время по формуле основания можно легко определить валентность атомов содержащегося в нем металла — она равна числу гидроксогрупп в формуле данного основания. Например, в формуле основания Fe(OH)2 две гидроксогруппы, следовательно, валентность атома железа в этом веществе равна II, а в основании Cr(OH)3 валентность атомов хрома равна III.
Как же называются основания? Известно, что продукты соединения воды с веществами называются гидратами. Если с водой соединяются оксиды металлов, то образуются гидраты оксидов металлов, или сокращенно гидроксиды металлов. Поэтому вещества Ca(OH)2 и NaOH, образующиеся при взаимодействии оксидов кальция и натрия с водой, называются «гидроксид кальция» и «гидроксид натрия».
По растворимости в воде основания делятся на растворимые и нерастворимые. Растворимые в воде основания называют щелочами. К их числу относятся KOH, NaOH, Ca(OH)2, Ba(OH)2 и некоторые другие.
Обнаружить присутствие растворимых в воде оснований (щелочей) можно по изменению окраски индикаторов. Кроме известных вам лакмуса и метилоранжа, для этих целей можно использовать еще один индикатор — фенолфталеин. Он не имеет окраски в воде и в растворе кислоты, но в присутствии щелочей этот индикатор окрашивается в малиновый цвет (см. рис. 111, табл. 13).
Реакция нейтрализации
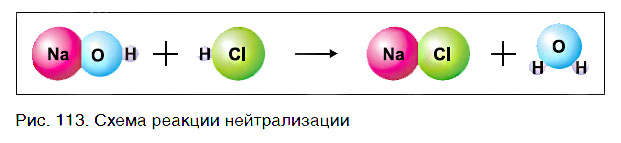
Как было показано, растворимые в воде основания — щёлочи — легко обнаружить с помощью индикаторов. Однако если к раствору гидроксида натрия NaOH прибавить фенолфталеин, а затем хлороводородную кислоту, то появившаяся вначале малиновая окраска после добавления кислоты исчезает (рис. 112).
Это свидетельствует о том, что кислота как бы уничтожила, или нейтрализовала, основание. Реакцию между кислотой и основанием, протекающую в этом случае, называют реакцией нейтрализации:
Реакция нейтрализации — это реакция между основанием и кислотой, в результате которой образуются соль и вода.
Реакция нейтрализации не относится ни к одному из известных вам до сих пор типов реакций (разложения, соединения, замещения). Это реакция нового типа — реакция обмена.
Реакциями обмена называются реакции между сложными веществами, в ходе которых они обмениваются своими составными частями.
Основание состоит из атомов металла и гидроксогрупп, а кислота — из атомов водорода и кислотного остатка. В результате реакции исходные вещества обменялись своими составными частями (рис. 113):
Краткие выводы урока:
- Основания — сложные вещества, состоящие из атомов металлов и гидроксогрупп.
- Реакция между основанием и кислотой, в ходе которой образуются соль и вода, называется реакцией нейтрализации.
- Реакция обмена — реакция между сложными веществами, в результате которой они обмениваются своими составными частями.
Надеюсь урок 29 «Понятие об основаниях» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
В (1754) году французский химик Г. Руэль ((1703)–(1770)) ввёл термин «основание», подразумевая, что к соединениям данного класса относится любое вещество, которое способно взаимодействовать с кислотами, образуя соли.
Гийом Франсуа Руэль
(1703)–(1770)
Позже значение этого термина неоднократно уточнялось. Одно из определений, которым пользуются в настоящее время, звучит так:
Основаниями называют сложные вещества, в состав которых входят металлические химические элементы, соединённые с одной или несколькими гидроксогруппами (группами атомов (-OH)).
Исходя из этого, общую химическую формулу оснований можно изобразить следующим образом:
где (M) — знак металлического химического элемента,
а (n) — индекс, численно совпадающий с валентностью металла.
Основания относятся к электролитам, то есть к веществам, растворы и расплавы которых проводят электрический ток.
С точки зрения теории электролитической диссоциации, основания — электролиты, которые, диссоциируя, из отрицательно заряженных ионов образуют только гидроксид-ионы.
Номенклатура оснований
Название основания состоит из слова «гидроксид» и названия металлического химического элемента в родительном падеже. Если металлический элемент имеет переменную валентность, то последняя указывается римскими цифрами в скобках без пробела сразу же после названия металла.
Пример:
— гидроксид железа((II)),
— гидроксид хрома((II)).
Растворимые в воде основания называют щелочами.
По их способности растворяться в воде основания делят на растворимые и практически нерастворимые.
|
Примеры: Ca(OH)2
— гидроксид кальция. |
Примеры: Cu(OH)2
— гидроксид меди((II)), Fe(OH)2
— гидроксид железа((II)), Cr(OH)2
— гидроксид хрома. |
Источники:
https://upload.wikimedia.org/wikipedia/commons/d/d5/Guillaume-Fran%C3%A7ois_Rouelle.jpg
Схема образования гидроксида натрия:
Na+ + H-O-H > NaOH + H+;
Уравнение реакции: 2Na + 2HOH = 2NaOH + H2
OH— — гидроксид-ион является сложным ионом.
Название основания = Гидроксид + Название металла в родительном падеже + С.О. римскими цифрами
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа (II)
Fe(OH)3 – гидроксид железа (III)
Дай название веществам: Ba(OH)2, KOH , Al(OH)3, Zn(HO)2. Воспользуйся тренажером. (Оценка за тренажер не входит в итоговую оценку. Нажми на ссылку ответь на вопросы и закрой страницу с тестами.)
Порядок составления формул оснований
При
составлении формулы конкретного основания, необходимо в таблице
растворимости найти ион металла, для которого составляем формулу, и в
соответствии с зарядом этого иона металла составить, формулу основания:
-
Если заряд иона металла «+», то с ионом металла связанна только одна гидроксогруппа OH—, например гидроксид натрия Na+OH;
-
Если «2+», то две Ca2+(OH)2.
Вопрос:
Заряд иона алюминия «3+» (Al3+) сколько гирдроксогупп связанно с алюминием в гидроксиде алюминия?
Запомни:
Оксиду металла соответствует основание: Ca > CaO > Ca(OH)2. Такие оксиды называют основные оксиды. СаО — основный оксид.
Составим основания из оксидов: Na2O , FeO , Fe2O3
|
Na+2O > Na+OH— |
Fe2+O > Fe+2(OH)2 |
Fe23+O3 > Fe3+(OH)3 |
|
|
|
|
Составь:
-
Основания из оксидов: ZnO , Li2O , MgO
-
Оксиды из оснований: CuOH , Cu(OH)2
* * *
.