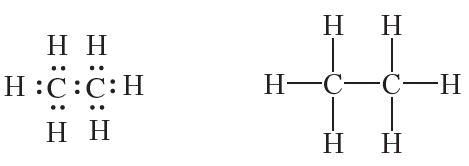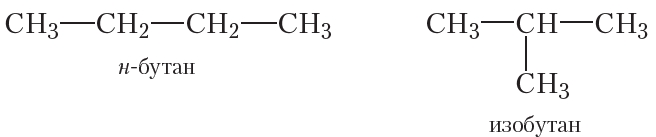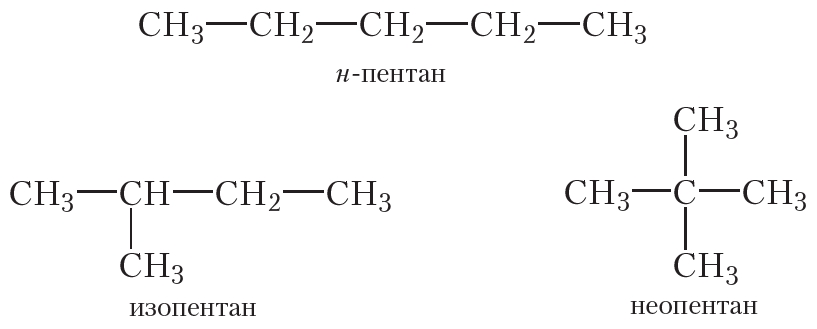Структурные формулы простейших углеводородов. Алканы. Изомерия алканов
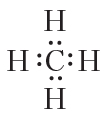
Простейшими по составу органическими соединениями являются углеводороды. Молекулы углеводородов состоят только из двух элементов: углерода и водорода. Простейшим углеводородом является метан. Молекулярная формула метана — CH4. Молекулярная формула отражает только состав молекулы метана. Рассмотрим строение молекулы метана.
Атом углерода имеет четыре валентных электрона, атом водорода — один. Это можно наглядно отобразить при помощи электронных формул:
Очевидно, что один атом углерода может образовать четыре ковалентные связи с четырьмя атомами водорода:
При этом атомы приобретают завершённые внешние электронные оболочки, углерод — восьмиэлектронную, водород — двухэлектронную.
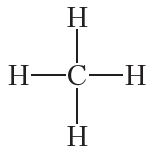
Приведённая электронная формула отражает строение молекулы метана CH4, в которой центральный атом углерода связан с четырьмя атомами водорода посредством четырёх общих электронных пар (четырёх ковалентных связей). На практике при отображении строения молекул органических веществ удобнее пользоваться структурными формулами. Структурная формула метана:
Структурные формулы, в отличие от молекулярных, отражают не только состав, но и последовательность соединения атомов в молекуле.
Метан представляет собой бесцветный горючий газ без запаха, нерастворимый в воде. Температура кипения метана очень низка и составляет –162 °С. Метан является основным компонентом природного газа. Кроме этого, он встречается в месторождениях каменного угля и его внезапные выбросы бывают причиной пожаров в угольных шахтах. Отсюда происходит название метана «рудничный газ». Выделения метана наблюдаются на торфяных болотах, этим обусловлено ещё одно его название — «болотный газ».
Составим структурную формулу следующего углеводорода — этана. Молекула этана содержит два атома углерода, соединённых одинарной связью. Учитывая, что углерод в органических веществах четырёхвалентен, легко составить электронную и структурную формулы молекулы этана:
Молекулярная формула этана — C2H6. Этан, как и метан, бесцветный горючий, нерастворимый в воде газ, имеющий температуру кипения –89 °С. Этан встречается в природе в составе природного газа.
В органической химии обычно пользуются структурными, а не молекулярными формулами веществ. Для того чтобы структурные формулы не были слишком громоздкими, отдельные связи в них, как правило, не указывают. В этом случае структурная формула этана будет выглядеть гораздо компактнее:
.
Следующий углеводород — пропан. Молекула пропана содержит цепь из трёх атомов углерода, соединённых одинарными связями. Структурные формулы молекулы пропана:
Подсчитав число атомов углерода и водорода в структурной формуле пропана, можно записать его молекулярную формулу — С3Н8. Пропан так же, как метан и этан, является бесцветным горючим газом, входит в состав природного газа.
Из четырёх атомов углерода можно построить два вида цепей: нормальную (неразветвлённую) и разветвлённую. Структурные формулы соответствующих углеводородов:

Как вы уже знаете из § 5, н-бутан и изобутан являются изомерами. Молекулы этих веществ имеют одинаковый качественный и количественный состав (молекулярная формула C4H10), но разное строение.
Изомерные н-бутан и изобутан при нормальных условиях — бесцветные газы без запаха, присутствуют в природном газе. Смесями пропана и изомерных бутанов, выделенными из природного газа, заполняют газовые баллоны, использующиеся в быту (рис. 6.1).
Из пяти атомов углерода, соединённых одинарными связями, можно построить молекулы трёх углеводородов:
Состав всех трёх углеводородов одинаков и соответствует молекулярной формуле С5Н12. То есть приведённые углеводороды являются изомерами.
Очевидно, что для углеводородов с бóльшим числом атомов углерода в молекуле число изомеров будет значительным. Так, например, изомерных углеводородов состава С20Н42 насчитывается более 300 000, а число возможных изомерных веществ состава С40Н82 составляет более чем 1012.
Явление изомерии во многом обусловливает многообразие органических соединений, делает органическую химию поистине неисчерпаемой.
Мы рассмотрели строение углеводородов, в которых атомы углерода связаны между собой только одинарными связями, остальные связи углерод образует с атомами водорода. Состав таких углеводородов описывается молекулярными формулами СН4, С2Н6, С3Н8, С4Н10, С5Н12 и т. д. Легко видеть, что для этих углеводородов можно предложить общую формулу:
СnH2n+2
Все углеводороды нециклического строения, в молекулах которых имеются лишь одинарные связи, будут соответствовать данной общей формуле. Такие углеводороды называются алканами.
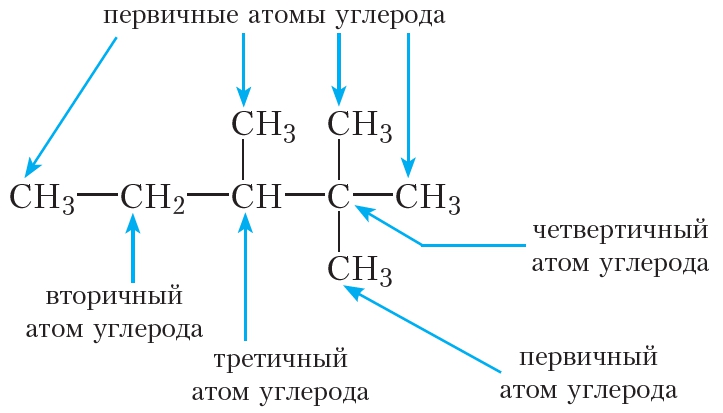
Атом углерода, связанный в углеродной цепи только с одним атомом углерода, называется первичным. Первичные атомы углерода являются концевыми элементами углеродной цепи. В молекуле этана оба атома углерода первичные.
Вторичный атом углерода связан с двумя атомами углерода. В молекуле пропана первый и третий атомы углерода являются первичными, второй атом — вторичным.
Третичный атом углерода связан с тремя атомами углерода; четвертичный — с четырьмя атомами углерода. Третичные и четвертичные атомы углерода являются точками разветвления углеродной цепи. Такие атомы углерода имеются в молекулах изопентана и неопентана (укажите их самостоятельно).
Углеводороды нециклического строения, в молекулах которых имеются только одинарные связи, называются алканами.
Общая формула алканов CnH2n+2.
Существуют два изомерных алкана состава С4Н10 и три изомерных алкана состава С5Н12.
Молекулярная формула этана
Найдите правильный ответ на вопрос ✅ «Молекулярная формула этана …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
zilwesont927
Вопрос по химии:
Напишите молекулярную, электронную и развёрнутую структурную формулы молекулы этана, определите валентность и степень окисления атомов углерода в этом соединении.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
slmelodo693
Молекулярная: C2H6
Структурная: H H
| |
H- C — С — H
| |
H H
Электронная: H H
∞ ∞
H : C : C : H
∞ ∞
H H
Валентность C= 4 , Н = 1
Степень окисления C = -3, H = +1
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат — это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи —
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Этан C2H6 – это предельный углеводород, содержащий два атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Гомологический ряд этана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение этана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3:
При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
Например, в молекуле этана C2H6 атомы водорода располагаются в пространстве в вершинах двух тетраэдров, центрами которых являются атомы углерода
Изомерия этана
Для этана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Химические свойства этана
Этан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для этана характерны радикальные реакции.
Этан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Этан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании этана сначала образуется хлорэтан:
CH3-CH3 + Cl2 = CH3-CH2Cl + HCl
Хлорэтан может взаимодействовать с хлором и дальше с образованием дихлорэтана, трихлорэтана, тетрахлорметана и т.д.
1.2. Нитрование этана
Этан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в этане замещается на нитрогруппу NO2.
CH3-CH3 + HNO3 = CH3-CH2NO2 + H2O
2. Дегидрирование этана
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, при дегидрировании этана образуются этилен или ацетилен:
3. Окисление этана
Этан – слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Этан горит с образованием углекислого газа и воды. Реакция горения этана сопровождается выделением большого количества теплоты.
C2H4 + 3O2 → 2CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении этана в недостатке кислорода может образоваться угарный газ СО или сажа С.
Получение этана
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения этана из хлорметана или бромметана. При этом происходит удвоение углеродного скелета.
2. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии пропионата натрия с гидроксидом натрия при сплавлении образуется этан и карбонат натрия:
CH3–CH2–COONa + NaOH → CH3–CH2–H + Na2CO3
3. Гидрирование алкенов и алкинов
Этан можно получить из этилена или ацетилена:
При гидрировании этилена образуется этан:
При полном гидрировании ацетилена также образуется этан:
4. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (3n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
Синтезом Фишера-Тропша можно получить этан:
2CO + 5H2 = C2H6 + 2H2O
5. Получение этана в промышленности
В промышленности этан получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
3 апреля 2023 10:45
605
Напишите молекулярную, электронную и развёрнутую структурную формулы молекулы этана, определите валентность и степень окисления атомов углерода в этом соединении.
Посмотреть ответы
Молекулярная: C2H6
Структурная: H H
| |
H- C — С — H
| |
H H
Электронная: H H
∞ ∞
H : C : C : H
∞ ∞
H H
Валентность C= 4 , Н = 1
Степень окисления C = -3, H = +1
Еще вопросы по категории Химия
Магний массой 48 г прореагировал с кислородом определите массу кислорода который вступил в реакцию…
приведите примеры хорошо растворимых, малорастворимых и практически нерастворимых в воде веществ различных классов, пользуясь таблицей растворимости…
Молекулярное строение имеет каждое из веществ,формулы которых приведены в ряду:1)Co2,NHO3,CaO 2)Na2S,Br2,NO2 3)H2SO4,Cu,O3 4) So2,I2,HCI Ответ:…
Пожаааалуууйста Почему числовые значения электроотрицательностей атомов элементов позволяет судить о химической связи,возникающей между атомами? Поясн…
Какая молекулярая масса Fe2(SO4)3?…