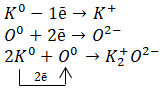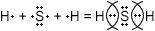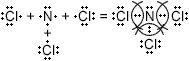S2
Электронная формула серы 1s22s22p63s23p4
На внешнем энергетическом уровне у серы 6 электронов, из которых 2 неспаренных на p-орбиталях:
До устойчивой электронной конфигурации сере не хватает двух электронов, поэтому между двумя атомами серы образуется две общие пары электронов (двойная связь):
Структурная формула: S=S
Такая связь является ковалентной неполярной.
K2O
Калий – это элемент IA группы 4-го периода с одним электроном на внешнем энергетическом уровне. Ему проще всего отдать электрон, чем принимать чужие.
Кислород – это элемент VIA группы 2-го периода с шестью электронами на внешнем энергетическом уровне. Для завершения уровня ему не хватает всего 2 электрона. Поэтому кислород – активный неметалл с высокой окислительной способностью.
Схема образования ионной связи:
H2S
Электронная формула водорода 1s1 и, казалось бы, ему легко отдать электрон. Однако не будем забывать, что водород находится в первом периоде, где всего 1 энергетический уровень, способный принять лишь 2 электрона. Таким образом, до завершения энергетического уровня водороду не хватает также одного электрона. Это объясняет высокую электроотрицательность водорода (ОЭО = 2,1) по сравнению с щелочными металлами. Тем не менее ОЭО серы выше (2,58) поэтому связь будет ковалентно полярная.
Электронная формула серы 1s22s22p63s23p4
Сере до завершения энергетического уровня не хватает двух электронов, поэтому она соединяется с двумя атомами водорода:
Структурная формула H-S-H, связь ковалентная полярная.
N2
У азота на внешнем энергетическом уровне 5 электронов и до устойчивой электронной конфигурации ему не хватает трёх электронов.
Электронная формула азота 1s22s22p3
Между атомами азота образуется три общие электронные пары (тройная связь):
Эта связь ковалентная неполярная.
Li3N
Литий – это элемент IA группы 2-го периода с одним электроном на внешнем энергетическом уровне. Относительно легко отдаёт электрон.
Электронная формула лития 1s22s1
У азота на внешнем энергетическом уровне 5 электронов и до устойчивой электронной конфигурации ему не хватает трёх электронов.
Электронная формула азота 1s22s22p3
Схема образования ионной связи:
Cl3N
Хлор имеет семь электронов на внешнем энергетическом уровне и до устойчивой электронной конфигурации ему не хватает всего одного электрона.
Электронная формула 1s22s22p63s23p7
У азота на внешнем энергетическом уровне 5 электронов и до устойчивой электронной конфигурации ему не хватает трёх электронов.
Электронная формула азота 1s22s22p3
Относительная электроотрицательность хлора 2,83, азота 3,07 поэтому связь будет ковалентная полярная.
Схема образования связи:
Лабораторный опыт №4
1. У атомов водорода и фосфора почти одинаковые значения ЭО. Каков тип химической связи в молекуле фосфина PH3?
3. В какой из молекул – хлороводорода HCl или фтороводорода HF – ковалентная химическая связь более полярна?
4. В следующих предложениях впишите пропущенные слова и выражения: «Ковалентная химическая связь образуется за счёт … . По числу общих электронных пар она бывает … . По ЭО ковалентную связь делят на … и … ».
5. Определите валентности элементов в соединениях с формулами: PbS, PbO2, FeS2, Fe2S3, SF6.
6. Запишите формулы хлоридов – соединений элементов с одновалентным хлором: железа (III), меди (I), меди (II), марганца (IV), фосфора (V).
Определите тип химической связи и запишите схему её образования для веществ с формулами:
а)
S
2
,
K
2
O
и
H
2
S
;
б)
N
2
,
L
i
F
и
C
l
3
N
.
reshalka.com
ГДЗ учебник по химии 8 класс Габриелян. §12. Вопросы и задания. Номер №2
Решение а
S
2
− ковалентная неполярная связь, так как она образована атомами одного и того же элемента.
Сера (S) — это элемент главной подгруппы VI группы, неметалл. Его атомы имеют по шесть электронов на внешнем уровне.
Чтобы определить число неспаренных электронов, воспользуемся формулой:
8 – N = число неспаренных электронов, где N— номер группы химического элемента.
Следовательно, атомы серы будут иметь (8 – 6 = 2) два неспаренный электрона.
В молекуле
S
2
атомы связаны двумя общими электронными парами, поэтому связь двойная.
Схема образования химической связи в молекуле
S
2
:
S = S
K
2
O
− ионная связь, так как она образована атомами элементов металла и неметалла.
Калий — это элемент главной подгруппы I группы Периодической системы Д.И. Менделеева, металл. Его атому легче отдать один внешний электрон, чем принять недостающие семь.
Кислород — элемент главной подгруппы VI группы, неметалл. Его атому легче принять 2 электрона, чем отдать 6 электронов с внешнего уровня.
Найдём наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2 (2 * 1). Затем определим, сколько атомов калия нужно взять,чтобы они отдали два электрона (т.е. надо взять 2 атома калия), и сколько атомов кислорода надо взять, чтобы они могли принять два электрона (т.е. нужно взять 1 атом кислорода).
H
2
S
− ковалентная полярная связь, так как она образована атомами разных элементов − неметаллов.
Водород (H) — это элемент главной подгруппы VII группы, неметалл. Его атомы имеют по семь электронов на внешнем уровне.
Непарных электронов будет: 8−7 = 1.
Сера (S) — это элемент главной подгруппы VI группы, неметалл. Его атомы имеют по шесть электронов на внешнем уровне.
Непарных электронов будет: 8−6 = 2.
Н − S − H
Общие электронные пары будут смещены от водорода к сере, как к более электроорицательному элементу.
Решение б
N
2
− ковалентная неполярная связь, так как она образована атомами одного и того же элемента.
Азот (N) — это элемент главной подгруппы V группы, неметалл. Его атомы имеют по пять электронов на внешнем уровне.
Непарных электронов будет: 8−5 = 3.
В молекуле
N
2
атомы связаны тремя общими электронными парами, поэтому связь тройная.
Схема образования химической связи в молекуле
N
2
:
L
i
F
− ионная связь.
Литий — элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7.
Фтор — элемент главной подгруппы VII группы, неметалл. Его атому легче принять 1 электрон, чем отдать 7 электронов с внешнего уровня.
Найдём наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 1 (1 * 1). Затем определим, сколько атомов лития нужно взять,чтобы они отдали один электрон (т.е. надо взять 1 атом лития), и сколько атомов фтора надо взять, чтобы они могли принять один электрон (т.е. нужно взять 1 атом фтора).
C
l
3
N
− ковалентная полярная связь.
Хлор (Cl) — это элемент главной подгруппы VII группы, неметалл. Его атомы имеют по семь электронов на внешнем уровне.
Непарных электронов будет: 8−7 = 1.
Азот (N) — это элемент главной подгруппы V группы, неметалл. Его атомы имеют по пять электронов на внешнем уровне.
Непарных электронов будет: 8−5 = 3.
Общие электронные пары будут смещены от азота к хлору, как к более электроорицательному элементу.
Вася Иванов
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
Надюсик Ковалёва
10.11.2020 16:56:10
Химия 10-11 класс
10 баллов
составить схемы образования таких молекул: O2, K2S, H2S
Ирина Каминкова
11.11.2020 01:25:01
Ответ эксперта
Все предметы
Рейтинг пользователей

- Калькуляторы
- Справочник
- Словарь
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,663 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,987 -
разное
16,906
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.