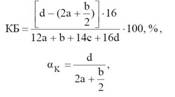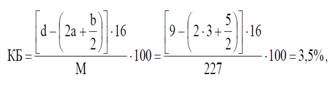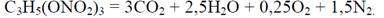Министерство
образования и науки Российской федерации
Федеральное
агентство по образованию
Государственное
образовательное учреждение
Высшего
профессионального образования
«Магнитогорский
государственный технический университет
им. Г.И.Носова»
факультет Горных
технологий и транспорта
кафедра подземной
разработки
месторождений
полезных ископаемых
ТЕХНОЛОГИЯ И
БЕЗОПАСНОСТЬ ВЗРЫВНЫХ РАБОТ
Лабораторный
практикум
для студентов
специальности 130400, 130404, 130406
Магнитогорск
2010
Содержание
|
Введение…………………………………………..……………………………… |
|
|
1. Расчет |
|
|
2. Определение |
|
|
3. |
|
|
4. Расчет, |
|
|
5. Изучение |
|
|
6. |
|
|
7. |
ВВЕДЕНИЕ
Практические
и лабораторные занятия по дисциплине
«Технология и безопасность взрывных
работ» имеет цель помочь студентам
ознакомиться с основами технологии
взрывных работ, теорией взрывчатых
веществ и способами ведения взрывных
работ. Приобрести навыки проведения
экспериментальных работ.
Задачей практических
занятий по данной дисциплине является
приобретение практических навыков и
дополнение теоретических знаний
технологии и безопасности ведения
буровзрывных работ. Формирование у
студентов знаний и умений по выбору
рациональных способов и оборудования
при производстве взрывных работ и
связанных с этим обеспечением безопасности.
Настоящие
указания содержат 7
работ по изучению характеристик
промышленных взрывчатых веществ,
способов и средств инициирования,
заряжания и взрывания зарядов, а также
методов расчета и составления паспорта
буровзрывных работ.
Практическая работа № 1 Расчет кислородного баланса и составление рецептуры промышленных взрывчатых веществ
Цель
работы: изучение состава взрывчатых
веществ и получение навыков расчета
химической реакции взрывчатого разложения
основных промышленных ВВ.
Общие сведения
Кислородный
баланс.
Кислородным балансом называется
отношение избытка или недостатка
кислорода во взрывчатом веществе для
полного окисления горючих элементов
(водорода, углерода, металлов и т.п.),
выраженное в грамм-атомах, к
грамм-молекулярной массе ВВ. Кислородный
баланс выражается в долях или процентах.
Под
полным окислением понимается окисление
водорода в воду, а углерода в углекислый
газ. При этом выделяется также молекулярный
азот и кислород. Если в составе ВВ
находится металл, то образуется его
высший окисел.
Реакции
полного окисления:
С
+ О2
→
СО2
+ 396
кДж/моль;
Н2
+ ½ О2
→
Н2О
+ 283 кДж/моль при воде жидкой;
Н2
+ ½ О2
→
Н2О
+ 241 кДж/моль при воде парообразной;
2Al
+ 1,5 О2
→
Al2О3
+ 1671 кДж/моль.
Следовательно,
если ВВ имеет состав в виде CaHbNcOd,
то кислородный баланс (%)

где
16 – относительная атомная масса
кислорода; МВВ
– молекулярная масса ВВ.
При
d>2a+b/2
имеем
положительный кислородный баланс;
при
d=2a+b/2
нулевой
кислородный баланс;
при
d<2a+b/2
отрицательный
кислородный баланс.
ВВ
с нулевым кислородным балансом выделяют
максимальное количество энергии и
минимальное количество ядовитых газов.
При
взрыве ВВ с отрицательным кислородным
балансом в зависимости от относительного
количества кислорода образуются либо
ядовитая окись углерода (угарный газ)
с меньшим выделением тепла, чем при
образовании углекислоты, т. е.
С
+0,5О2
→
СО
+ 109
кДж/моль,
либо чистый углерод
в виде сажи, резко снижающий образование
газов.
При
положительном кислородном балансе
уменьшается выделение энергии, так как
образуется ядовитая окись азота с
поглощением тепла по реакции
0,5N2
+ 0,5О2
→
NО
– 90,5 кДж/моль.
Пример 1. Определить
кислородный баланс тротила С7Н5(NO2)3,
относительная молекулярная масса
которого 227.
Для полного окисления
необходимо 2а + b/2
или 2•7 + 5/2= 16,5 атомов кислорода.
В наличии имеется
6 атомов кислорода. Следовательно,

Пример 2. Определить
кислородный баланс граммонита 30/70.
Граммонит 30/70 состоит из 30% аммиачной
селитры NH4NО3
и 70% тротила.
Кислородный баланс
аммиачной селитры АС, определенный
вышеуказанным способом, равен 20%.
Кислородный баланс
граммонита 30/70
0,3•20 +0,7 (-74) = -45,8%.
Рецептура
промышленных ВВ.
При изготовлении промышленных ВВ обычно
состав подбирается таким, чтобы был
нулевой кислородный баланс. Для
изготовления патронированных ВВ
принимается небольшой положительный
кислородный баланс для окисления
материала оболочки патронов. Для
подземных работ ВВ не должен образовывать
ядовитых газов более 40 л в пересчете на
условную окись углерода при взрыве 1
кг. Если образуются окислы азота и
сернистый газ, то для перевода их к
условной окиси углерода принимается
поправочный коэффициент соответственно
6,5 и 2,5.
Для
открытых горных работ, особенно для ВВ,
применяемых в обводненных условиях,
требования к кислородному балансу ВВ
не столь жестки.
Пример 1. Составить
рецептуру игдаиита с нулевым кислородным
балансом на основе аммиачной селитры
и дизельного топлива (ДТ) с кислородным
балансом -320%.
Количество весовых
частей аммиачной селитры для окисления
одной части дизельного топлива равно

Содержание дизельного
топлива во взрывчатом веществе

Соответственно
содержание аммиачной селитры
100-х=100-5,9=94,1%.
Следовательно,
формула игданита
94,1% AC + 5,9% ДТ.
Пример 2. Определить
рецептуру ВВ с нулевым кислородным
балансом на основе аммиачной селитры
и тротила C7H5(NО2)3.
Кислородный баланс
тротила -74%, относительная молекулярная
масса 227. Кислородный баланс аммиачной
селитры +20%, относительная молекулярная
масса 80.
Состав смеси должен
отвечать условию:
х (—74%) + (100 — х) 20%
= 0,
где х — содержание
в смеси тротила, %.
Решение данного
уравнения показывает, что х≈ 21% и (100 —
х) = 79%. Такому составу смеси отвечают
граммонит 79/21 и аммонит 6ЖВ.
Обозначим число
молей аммиачной селитры через y,
число молей тротила через z. Тогда из
соотношения

получим

Приняв z=1, получим
у = 10,7.
Следовательно,
молекулярное уравнение граммонита
имеет вид
z+10,7y =
C7H5(NO2)3+10,7NH4NO3.
Пример 3. Определить
молекулярную формулу гранулита АС-8,
имеющего следующий состав:
89% аммиачной селитры
NH4NО3;
3% солярового масла С16Н34
(относительная молекулярная масса 226);
8% алюминиевой пудры
Аl
(относительная молекулярная масса —27).
Обозначив число
молей солярового масла х, аммиачной
селитры y,
алюминиевой пудры z,
можно написать химическую формулу в
виде
yNH4NO3+
xС16Н34+
zAl
В соответствии с
весовым составом можно записать следующие
соотношения

Отсюда у=83,9х;
z=
22,4х.
Примем х=1. тогда
молекулярное уравнение гранулита АС-8
имеет вид
83,9NH4NО3+С16Н34+
22,4Аl.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Кислородный баланс
Кислородный баланс характеризует соотношение между содержанием во взрывчатом веществе горючих элементов и кислорода.
Вычисляют кислородный баланс обычно как разность между весовым количеством кислорода, содержащегося во ВВ, и количеством кислорода, потребным для полного окисления горючих элементов, входящих в его состав.
Расчет ведут на 100 г ВВ, в соответствии, с чем кислородный баланс выражают в процентах. Обеспеченность состава кислородом характеризуется кислородным балансом (КБ) или кислородным коэффициентом ak, которые в относительных величинах выражают избыток или недостаток кислорода для полного окисления горючих элементов до высших оксидов, например, СО2и Н2О.
Если ВВ содержит как раз столько кислорода, сколько нужно для полного окисления входящих в его состав горючих элементов, то кислородный баланс его равен нулю.
Если избыток – КБ положителен, при недостатке кислорода – КБ отрицателен.
Сбалансированность ВВ по кислороду соответствует КБ – 0; ak= 1.
Если ВВ содержит углерод, водород, азот и кислород и описывается уравнением СаHbNcOd, то величины кислородного баланса и кислородного коэффициента могут определяться по формулам
a, b, c, d – число атомов соответственно С, H, N и O. В химической формуле ВВ; 12, 1, 14, 16 –округленные до целого числа атомной массы соответственно.
Знаменатель определяет молекулярную массу ВВ: М=12а+b+14с+16d.
a, b, c, d – число атомов соответственно С, H, N и O. В химической формуле ВВ; 12, 1, 14, 16 –округленные до целого числа атомной массы соответственно.
Знаменатель определяет молекулярную массу ВВ: М=12а+b+14с+16d.
Расчет состава продуктов взрывчатого разложения ВВ с положительным кислородным балансом (I группа ВВ)
При составлении уравнений реакций взрыва ВВ с положительным кислородным балансом руководствуются следующими положениями: углерод окисляется до углекислоты СО2, водород до воды Н2О, азот и избыток кислорода выделяются в элементарном виде (N2, O2).
Пример 1. Составить уравнение реакции (определить состав продуктов взрыва) взрывчатого разложения индивидуального ВВ.
Нитроглицерин: С3Н5(ONO2)3, М = 227.
Определяем величину кислородного баланса для нитроглицерина:
КБ > 0 Запишем уравнение реакции:
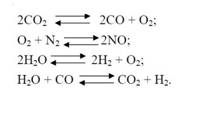
Кроме основной реакции протекают реакции диссоциации:
Но так как КБ = 3, 5 (намного больше нуля) –реакции смещены в сторону образования СО2, Н2О, N2, следовательно доля газов СО, Н2и NО в продуктах взрывчатого разложения незначительна и ими можно пренебречь.
Расчет состава продуктов взрывчатого разложения ВВ с отрицательным кислородным балансом (II группа ВВ) при составлении уравнений реакций взрывчатого разложения ВВ II группы необходимо учитывать следующие особенности:
• водород окисляется до Н2О,
• углерод окисляется до СО,
• оставшийся кислород окисляет часть СО до СО2,
• азот выделяется в виде N2.
Пример 2. Составить уравнение реакции взрывчатого разложения пентаэритриттетранитрата (тэна) С(СН2ОNO2)4, М = 316. КБ = – 10, 1%.
1. Составляем уравнение реакции разложения тэна:
Для определения величины коэффициентов СО и СО2:
5СО + 1, 5О2= хСО + уСО2,
х + у = n –сумма атомов углерода,
х + 2у = m –сумма атомов кислорода,


Задачи для самостоятельного решения( прислать на почту mitrofanovanngasu@yandex. ru до 25. 05)
1. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва 10 кг бутилового спирта (С4Н9ОН): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
2. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва5 кг метана (СН4): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
3. Рассчитать мощность (тротиловый эквивалент)возможного аварийного взрыва 20 кг глицерина (С3Н8О3): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
4. Определить количество взорвавшихся паров пропана (С3Н8), если после аварии отмечены разрушения на расстоянии 25 м от эпицентра взрыва. Взрыв произошел в технологическом оборудовании.
5. Рассчитать мощность (тротиловый эквивалент)возможного аварийного взрыва 40 кг ксилола (С8Н10): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
6. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва15 кг диметилгептана (С9Н20): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
7. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва при взрыве 30 кг диметилбутана (С6Н14): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
8. Определить количество взорвавшихся паров бензола(С6Н6), если послеаварии отмечены разрушения на расстоянии 100 м от эпицентра взрыва. Взрыв произошел в помещении.
9. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва при взрыве 25 кг диметилового эфира (С2Н6О): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
10. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва 5 кг бензола (С6Н6): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
11. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва при взрыве 12 кг дибутилового эфира (С4Н10О): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
12. Определить количество взорвавшихся паров меана (СН4), если после аварии отмечены разрушения на расстоянии 14 м от эпицентра взрыва. Взрыв произошел в технологическом оборудовании.
13. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва при взрыве 2 кг нитроэтана (С2Н5NО2): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
14. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва при взрыве 15 кг уксуснобутилового эфира (С6Н12О): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
15. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва при взрыве 15 кг этилбензола (С8Н10): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
16. Определить количество взорвавшихся паровтолуола (С7Н8), если послеаварии отмечены разрушения на расстоянии 100 м от эпицентра взрыва. Взрыв произошел в помещении.
17. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва при взрыве 5 кг этиленгликоля (С2Н6О): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
Кислородный баланс некоторых химических веществ
В пиротехнических расчетах иногда требуется знать кислородный баланс вещества, участвующий в реакции.
Кислородный баланс (n) — величина, показывающая количество вещества кислорода в граммах, необходимое для полного сжигания всех горючих веществ в 100 г пиротехнической смеси.
Если при сжигании пиротехнической смеси достигается необходимый эффект, то такая смесь считается с оптимальным кислородным балансом.
Кроме того, выделяют смеси с положительным, нулевым и отрицательным кислородным балансом.
Составы с положительным кислородным балансом, содержат, как правило, избыток окислителя и в пиротехнике применяются только в исключительных случаях.
Наиболее распространены смеси с нулевым и отрицательным кислородными балансами. Если в смесях окислитель содержится в количестве, необходимом для полного сгорания всего горючего, то такая смесь с нулевым кислородным балансом. И, наоборот, составы, содержащие окислитель в количестве, недостаточном для полного сгорания горючего, называют составами с отрицательным кислородным балансом.
Если в качестве окислителя используют бескислородные вещества, имеющие в своем составе атомы галогенов, то тогда речь идет об хлорном и фторном балансах.
В ниже приведенной таблице содержатся значение кислородного баланса для распространенных химических веществ.
| Вещество | Формула | Атомный или молекулярный вес | Кислородный баланс | Содержание азота, % |
|---|---|---|---|---|
| Алюминий | Al | 26.9815 | -0.89 | — |
| Аммония карбонат | (NH4)2CO3 | 96.0862 | -0.522 | — |
| Аммония нитрат | NH4NO3 | 80.0434 | 0.2 | 35 |
| Аммония перхлорат | NH4ClO4 | 117.489 | 0.34 | — |
| Аммония пикрат | NH4C6H2(NO2)3O | 246.136 | -0.52 | 22.76 |
| Аммония сульфат | (NH4)2SO4 | 132.141 | -0.364 | — |
| Аммония хлорид | NH4Cl | 53.4912 | -0.449 | — |
| Антрацен | C14H10 | 178.233 | -2.966 | — |
| Бария нитрат | Ba(NO3)2 | 261.337 | 0.306 | 10.72 |
| Бария хлорат | Ba(ClO3)2·H2O | 322.244 | 0.298 | — |
| Бария хромат | BaCrO4 | 253.321 | 0.095 | — |
| Бария перекись | BaO2 | 169.326 | 0.094 | — |
| Бария силицид | BaSi2 | 193.498 | -0.412 | — |
| Бумага | — | — | -1.3 | — |
| Вазелин | C18H38 | 254.5 | -3.47 | — |
| Глицерин | C3H5(OH)3 | 92.0947 | -1.228 | — |
| Глюкоза | C6H12O6 | 180.158 | -1.065 | — |
| Гремучая ртуть | Hg(ONC)2 | 284.624 | -0.113 | 9.85 |
| Декстрин | C6H10O5 | 162.142 | -1.185 | — |
| Динитробензол | C6H4(NO2)2 | 168.109 | -0.953 | 16.6 |
| Динитроглицерин | C3H5(ONO2)2OH | 182.09 | -0.293 | 16.86 |
| Динитроксилол | C6H2(NO2)2(CH3)2 | 196.163 | -1.305 | 14.28 |
| Динитронафталин | C10H6(NO2)2 | 218.169 | -1.394 | 12.84 |
| Динитрохлоргидрин | C3H5(ONO2)2Cl | 200.535 | -0.16 | 13.97 |
| Динитрофенол | C6H3(NO2)2OH | 184.108 | -0.782 | 15.21 |
| Динитротолуол | C6H3(NO2)2CH3 | 182.136 | -1.144 | 15.38 |
| Дициандиамид | (CN)2(NH2)2 | 84.0807 | -1.143 | 66.6 |
| Калия бихромат | K2Cr2O7 | 294.185 | 0.163 | — |
| Калия нитрат | KNO3 | 101.103 | 0.396 | 13.86 |
| Калия хлорат | KClO3 | 122.549 | 0.392 | — |
| Калия перхлорат | KClO4 | 138.549 | 0.462 | — |
| Калия пикрат | C6H2(NO2)3OK | 267.196 | -0.389 | 15.75 |
| Кальция нитрат | Ca(NO3)2∙4H2O | 236 | 0.339 | 11.73 |
| Кальция перхлорат | Ca(ClO4)2 | 238.979 | 0.536 | — |
| Кальция хлорат | Ca(ClO3)2 | 206.98 | 0.464 | — |
| Кальция силицид | CaSi2 | 96.249 | -0.833 | — |
| Камфора | C10H16O | 152.236 | -2.842 | — |
| Керосин | — | — | -3.43 | — |
| Клетчатка | C6H10O5 | 162.142 | -1.185 | — |
| Крахмал | C6H10O5 | 162.142 | -1.185 | — |
| Маннит | C6H8(OH)6 | 182.174 | -1.143 | — |
| Мононитроглицерин | C3H5(ONO2)(OH)2 | 137.092 | -0.526 | 10.21 |
| C10H7NO2 | 173.171 | -1.988 | 8.09 | |
| Мононитрохлоргидрин | C3H5(ONO2)OHCl | 155.538 | -0.488 | 9 |
| Мононитротолуол | C6H4(NO2)CH3 | 137.138 | -1.81 | 10.21 |
| Мононитрофенол | C6H4(NO2)OH | 139.111 | -1.324 | 10.07 |
| Мука злаков | C15H25O11 | 381.357 | -1.32 | — |
| Мука древесная (очищ.) | C15H22O10 | 362.334 | -1.37 | — |
| Мука древесная (опилки) | — | — | -1.35 | — |
| Масло (растительное) | C23H36O7 | 424.535 | -2.15 | — |
| Натрия нитрат | NaNO3 | 84.995 | 0.47 | 16.47 |
| Натрия хлорат | NaClO3 | 106.441 | 0.45 | — |
| Натрия перхлорат | NaClO4 | 122.44 | 0.522 | — |
| Натрия пикрат | C6H2(NO2)3ONa | 251.088 | -0.414 | 16.73 |
| Нафталин | C10H8 | 128.174 | -3 | — |
| Нитробензол | C6H5NO2 | 123.111 | -1.627 | 11.38 |
| Нитроглицерин | C3H5(ONO2)3 | 227.088 | 0.035 | 18.5 |
| Нитрогуанидин | C(NH2)2NNO2 | 104.069 | -0.308 | 53.84 |
| Нитроклетчатка (коллоксилин) | C24H31N9O38 | 1053.55 | -0.387 | 11.96 |
| Нитроклетчатка (пироксилин) | C24H29N11O42 | 1143.54 | -0.286 | 13.47 |
| Нитрокрахмал | — | -0.335 | 12.75 | |
| Нитроманнит | C6H8(NO3)6 | 452.159 | 0.071 | 18.58 |
| Парафин | C24H50 | 338.661 | -3.46 | — |
| Пикриновая кислота | C6H2(NO2)3OH | 229.106 | -0.454 | 18.34 |
| Сахар (тростниковый) | C12H22O11 | 342.3 | -1.122 | — |
| Сера | S | 32.066 | -1 | — |
| Свинца нитрат | Pb(NO3)2 | 331.21 | 0.242 | 8.45 |
| Скипидар | C10H16 | 136.237 | -3.294 | — |
| Стронция нитрат | Sr(NO3)2 | 211.63 | 0.378 | 13.25 |
| Сурьма сернистая | Sb2S3 | 339.718 | -0.429 | — |
| Сурьма металлическая | Sb | 121.76 | -0.2 | — |
| Таннин | C14H10O9 | 322.228 | -1.193 | — |
| Тетранитроанилин | C6H(NH2)(NO2)4 | 273.119 | -0.322 | 25.64 |
| Тетранитродиглицерин | (C3H5)2O(NO3)4 | 346.165 | -0.185 | 16.18 |
| Тетранитродиметиланилин | C6H(NO2)3N(CH3)2 | 255.167 | -0.612 | 23.25 |
| Тетранитрометан | C(NO2)4 | 196.033 | 0.49 | 28.57 |
| Теранитрометиланилин | C6H2(NO2)4NCH3 | 287.146 | -0.474 | 24.38 |
| Тетранитронафталин | C10H4(NO2)4 | 308.164 | -0.727 | 18.18 |
| Тринитроанилин | C6H2(NO2)3NH2 | 228.121 | -0.566 | 24.56 |
| Тринитробензол | C6H3(NO2)3 | 213.106 | -0.563 | 19.71 |
| Тринитродиметиланилин | C6H2(NO2)3N(CH3)2 | 256.175 | -0.875 | 21.88 |
| Тринитрокрезол | C6HCH3(NO2)3OH | 243.133 | -0.626 | 17.28 |
| Тринитронафталин | C10H5(NO2)3 | 263.166 | -1.004 | 15.97 |
| Тринитрорезорцин | C6H(NO2)3(OH)2 | 245.105 | -0.359 | 17.14 |
| Тринитротолуол | C6H2(NO2)3CH3 | 227.133 | -0.74 | 18.5 |
| Уголь | C | 12.011 | -2.667 | — |
| Фенол | C6H5OH | 94.113 | -2.383 |
— |